
【题目】将4gNaOH和0.1mol Na2CO3混合并配成溶液,向溶液中滴加1.0molL﹣1稀盐酸.下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.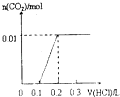
B.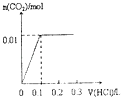
C.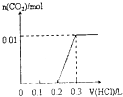
D.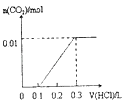
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
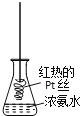
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
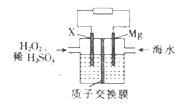
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
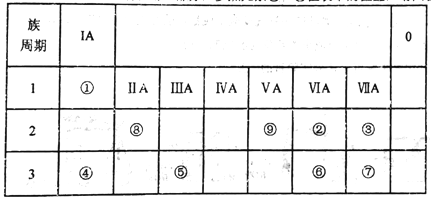
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
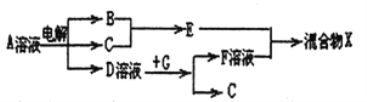
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )

A. A为电源的正极
B. 溶液中H+从阳极向阴极迁移
C. Ag-Pt电极的电极反应式为:2NO3-+12H++10e- = N2↑+ 6H2O
D. 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__________v逆(填“>”<”或“=”)。
(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是
A. 生石灰、白磷、熟石灰 B. 空气、氮气、胆矾
C. 干冰、铁、氯化氢 D. 烧碱、水银、碘酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com