
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
分析 锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为Zn+H2SO4=ZnSO4+H2 ↑.
设当导线中有1mol电子通过时,理论上负极锌片溶解x,铜片上析出氢气y.
Zn+H2SO4=ZnSO4+H2 ↑ 转移电子
65g 2g 2mol
x y 1mol
x=32.5g
y=1g,所以①③正确;
故选A.
点评 本题以原电池原理为载体考查了物质的量的有关计算,难度不大,根据电池反应式计算即可.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶体中105B和115B两种同位素原子的质量比为1:4 | |
| B. | 5.4 g该晶体硼所含中子为2.9 mol | |
| C. | 等质量的分别由105B和115B构成的晶体硼所含中子数之比为6:5 | |
| D. | 若碳原子质量为w g,则105B原子的质量为10w g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
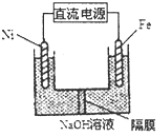
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
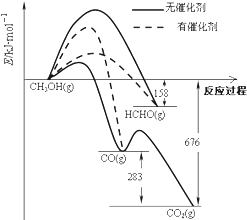 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
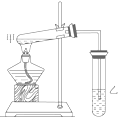 如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com