
【题目】向Cu和CuO的混合物中加入0.6 L 2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
【答案】19.2 g 1 mol 1 L(或者1000mL)
【解析】
(1)Cu和CuO的混合物和硝酸反应时,只有Cu可以将硝酸还原成NO,n(NO)=![]() =0.2mol,根据电子守恒n(Cu)=
=0.2mol,根据电子守恒n(Cu)=![]() =0.3mol,质量为0.3mol×64g/mol=19.2g;
=0.3mol,质量为0.3mol×64g/mol=19.2g;
(2)沉淀充分灼烧后得到的物质为CuO,n(CuO)=![]() =0.4mol,所以混合物和硝酸反应后溶液中n[Cu(NO3)2]=0.4mol,根据元素守恒可知消耗的硝酸的物质的量=0.4mol×2+0.2mol=1mol;
=0.4mol,所以混合物和硝酸反应后溶液中n[Cu(NO3)2]=0.4mol,根据元素守恒可知消耗的硝酸的物质的量=0.4mol×2+0.2mol=1mol;
(3)当铜离子完全沉淀时,溶液中的溶质为NaNO3,根据元素守恒n(NaOH)= n(NaNO3)=2mol/L×0.6L-0.2mol=1mol,NaOH溶液的浓度为1.0 mol/L,所以V(NaOH)=1L。


科目:高中化学 来源: 题型:
【题目】下表为部分短周期非金属元素的性质或原子结构,已知A﹣D的原子序数依次增大。
元素编号 | 元素性质或原子结构 |
A | A原子所处的周期数、族序数、原子序数均相等 |
B | 核外电子有6种不同运动状态 |
C | 最简单氢化物的水溶液呈碱性 |
D | 基态原子的s轨道电子数等于p轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号):
(1)写出C原子的电子排布图________。
(2)A,B,C,D的第一电离能由大到小的顺序为________。
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因________。按照共价键理论,分子中每个原子的最外电子层电子数均已饱和,已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是______,向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为_______,分子中C的原子的杂化类型是______;若无配位键则ABCD的结构式为______分子中D原子的杂化类型为________。
(5)BD2的电子式是________将D原子换成等电子的 ![]() 所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
(6)在ABCD的三种可能结构中B原子的杂化类型________(填“相同”或“不相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJmol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能/(kJmol-1) | 436 | 243 | 431 |
根据以上信息可知,1molH2在足量的氯气中燃烧生成氯化氢气体放出的热量是_______
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
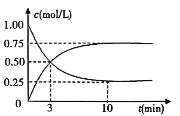
①从反应开始到平衡,CH3OH的平均反应速率υ(CH3OH)=_______________。
②若反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.υ(CO2)=0.15molL-1min-1 B.υ(H2)=0.01molL-1s-1
C.υ(CH3OH)=0.2molL-1min-1 D.υ(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为___________(填字母)
(3)海水化学资源的利用具有非常广阔的前景,从海水中提取溴的工业流程如图所示:
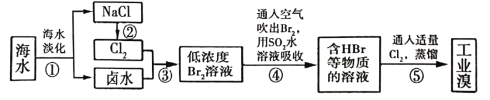
①以上五个过程中涉及氧化还原反应的有_____________个。
②步骤③中已获得游离态的溴,步骤④又随之转变成化合态的溴,其目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )
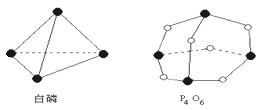
A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物与金属钠反应放出氢气,充分燃烧8.88 g该有机物,将燃烧后的气体通入浓硫酸,浓硫酸质量增加10.8 g;将剩余气体通入NaOH溶液,溶液质量增加21.12 g。由质谱仪测得此种有机物的相对分子质量为74。该有机物在浓硫酸的作用下发生消去反应时能生成两种有机产物。则该有机物可能的结构简式为 ( )
A. CH3CH2CH2CH2OH
B. CH3CH2CHOHCH3
C. (CH3)2CHCH2OH
D. (CH3)3COH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。如乙醚的结构简式为CH3—CH2—O—CH2—CH3,其核磁共振氢谱中给出的峰值(信号)有两种。化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为________________,请预测B的核磁共振氢谱上有________种峰值(信号)。
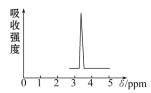
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )

A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有3种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
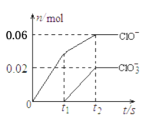
A.苛性钾中KOH的物质的量为0.24mol
B.反应中转移电子的物质的量是0.21mol
C.有2.688L氯气参与反应
D.酸性条件下ClO-和ClO![]() 可生成Cl2
可生成Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com