
| A. |  移取醋酸 | B. | 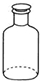 盛装NaOH溶液 | C. | 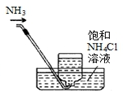 收集氨气 | D. | 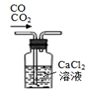 除去杂质CO2气体 |
分析 A.醋酸为酸性溶液,需要使用酸式滴定管量取;
B.氢氧化钠为碱性溶液,不能使用玻璃塞的试剂瓶盛放;
C.氨气极易溶于水,不能使用排水法收集;
D.二氧化碳都不与氯化钙溶液反应,无法除去二氧化碳.
解答 解:A.醋酸为弱酸,移取醋酸时需要使用酸式滴定管,图示仪器为酸式滴定管,故A正确;
B.氢氧化钠溶液能够与玻璃塞中的二氧化硅反应,不能使用玻璃塞的试剂瓶盛放,应该使用橡胶塞的试剂瓶,故B错误;
C.氨气极易溶于水,收集氨气不能使用排水法,可以使用排空气法,故C错误;
D.二氧化碳气体不与氯化钙溶液反应,不能使用氯化钙溶液除去一氧化碳的中的二氧化碳,可以使用氢氧化钠溶液,故D错误;
故选A.
点评 本题考查了试剂的存放、气体的收集方法、物质的分离与除杂、仪器的使用方法等知识,题目难度不大,试题知识点较多,充分考查了学生的分析能力及灵活应用基础知识的能力,注意掌握常见试剂的性质及存放方法,明确物质分离与提纯的方法与原则.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 镍及其化合物应用广泛
镍及其化合物应用广泛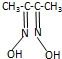 ) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
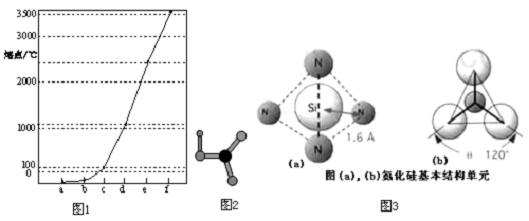
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的液态水和冰,液态水的能量高 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒直径不相同 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 用福尔马林灭掉活埃博拉病毒是利用了蛋白质变性原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
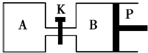 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )| A. | 500℃达平衡时有:c1>c2 | |
| B. | 500℃达平衡时有:a>b>c | |
| C. | 达平衡后打开K,容器B的体积将减小 | |
| D. | 此反应的平衡常数随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
组别 | 甲 | 乙 | 丙 |
| A | NO | NH3 | H2O |
| B | CO2 | Na2CO3 | Ba(OH)2 |
| C | Al | Fe2O3 | HCl |
| D | Cl2 | FeCl2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体 | B. | 悬浊液 | C. | 溶液 | D. | 乳浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com