
| A. | H2O2 | B. | N2 | C. | C2H4 | D. | BeCl2 |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,单键中含有一个σ键,双键中含有一个σ键和一个π键;据此分析.
解答 解:A.H2O2分子中共价键为极性键和非极性键,含有σ键,故A错误;
B.N2中只存在非极性键,没有极性键,故B错误;
C.C2H4中含有碳氢极性键和碳碳非极性键,由于分子结构对称,C2H4分子为非极性分子,C=C中含有一个σ键和一个π键,故C正确;
D.BeCl2中含有Be-Cl极性键,没有非极性键,故D错误;
故选:C.
点评 本题考查化学键的极性、分子极性,题目难度不大,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,试题培养了学生灵活应用所学知识解决实际问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O中所含原子总数为NA | |
| B. | 质量均为7.8 g的Na2S、Na2O2固体中含有的阴离子数均为0.1NA | |
| C. | 标准状况下,2.24 L Cl2通入足量H2O,转移的电子数均为0.1NA | |
| D. | 常温下,浓度为0.01mol/L的Na2CO3溶液中CO32-的数目为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
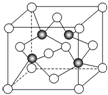 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中 N-Cl键是非极性键 | B. | 分子中不存在孤对电子 | ||
| C. | 三氯化氮分子结构呈三角锥形 | D. | 因N-Cl 键键能大,它的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子化合物(填“共价”或“离子”).
,该化合物属于离子化合物(填“共价”或“离子”). ,该化合物含的化学键类型是共价键.
,该化合物含的化学键类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间消耗0.2 mol/L B同时生成0.2 mol/L C | |
| C. | 容器内压强不随时间变化 | |
| D. | 容器内B的浓度不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
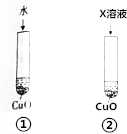 氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.
氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氯气中燃烧产生黄色烟 | |
| B. | 锌和碘的混合粉末加几滴水有紫色气体产生 | |
| C. | 镁在空气中燃烧发出耀眼的白光 | |
| D. | 铜在氯气中燃烧产生棕黄色的烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com