
| A、m值等于3 |
| B、平衡时,体系中c(A):c(B):c(C)=4:9:8 |
| C、A的转化率为40% |
| D、用B表示该反应的平均反应速率为0.08mol?L-1?min-1 |
| 0.4 |
| 1 |
| ||
| 3 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
70 30 |
208 82 |
| A、111 | B、112 |
| C、113 | D、114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时间容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升至800℃时,若上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B、可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| C、在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| D、25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI溶液,有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50% | B、33.3% |
| C、25% | D、20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
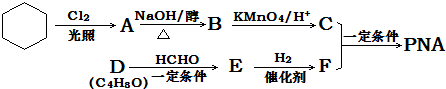
| KMnO4/H+ |
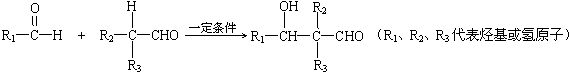
查看答案和解析>>
科目:高中化学 来源: 题型:
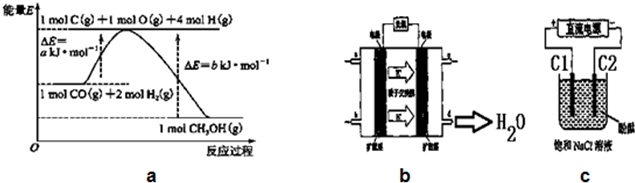
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com