
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol·L-1的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
科目:高中化学 来源: 题型:
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2(s)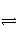
 Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A的原子结构示意图为: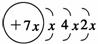 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________,B________,C________,D________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是________。
(4)画出D的核外电子排布图________,这样排布遵循了________原理和________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
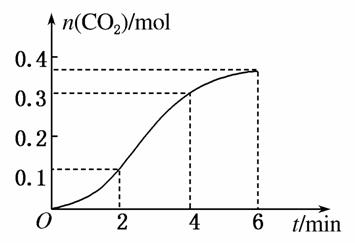
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·L-1的氨水b L,②c(OH-)=10-3 mol·L-1的氨水c L,③c(OH-)=10-3 mol·L-1的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
向1.0 L 0.30 mol·L-1的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.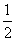 c(Na+)=c(HCO
c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)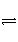
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
日本大地震、海啸引发多处核险情。下列说法中正确的是( )
A.核能是一种清洁、环保、安全的新能源
B.核变化属于化学变化
C.氢气的燃烧热最高,且来源丰富、无污染,是一级能源
D.将煤制成气体燃料或液体燃料,可以提高其燃烧效率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com