
分析 (1)根据题中信息及及氧化还原反应知识写出反应方程式:XeF2与水仅发生氧化还原反应为:2XeF2+2H2O→2Xe↑+O2↑+4HF ①
XeF4与水发生氧化还原反应为:3XeF4+6H2O→Xe↑+2XeO3+12HF ②
另一半的XeF4发生歧化反应为:XeF4+2H2O→Xe↑+O2↑+4HF ③
有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应,③×3+②可得XeF4与水反应的总方程式:6XeF4+12H2O→4Xe↑+3O2↑+2XeO3+24HF,
然后分别根据PV=nRT计算出氧气和总气体的物质的量,设出XeF2和XeF4的物质的量,再分别根据生成氧气的物质的量、生成Xe的物质的量列式计算即可;
(2)原溶液中n(SO42-)=n(BaCl2)=0.4L×4mol/L=1.6mol,
假设原溶液中只有CuSO4,由Fe+Cu2+=Cu+Fe2+可知,则参加反应的n(Fe)=n(CuSO4)=1.6mol,反应的铁粉质量为:1.6mol×56g/mol=89.6g,
假设原溶液中只有Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4可知,则参加反应的n(Fe)=1.6mol×$\frac{1}{3}$,反应的铁粉质量为:1.6mol×$\frac{1}{3}$×56g/mol=22.9g,
所以21.7g铁粉会完全反应,没有剩余,最后得到16.8g残留固体为铜,
因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2(SO4)3=3FeSO4,Fe3+反应完毕后发生Fe+CuSO4=FeSO4+Cu,根据方程式计算生成16.8gCu消耗Fe的质量,进而计算与Fe2(SO4)3反应消耗Fe的质量,根据方程式计算n[Fe2(SO4)3],再根据硫酸根守恒计算n(CuSO4),根据c=$\frac{n}{V}$计算硫酸铜溶液的浓度.
解答 解:(1)XeF2与水仅发生氧化还原反应为:2XeF2+2H2O→2Xe↑+O2↑+4HF ①
XeF4与水发生氧化还原反应为:3XeF4+6H2O→Xe↑+2XeO3+12HF ②
XeF4发生歧化反应为:XeF4+2H2O→Xe↑+O2↑+4HF ③
有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应,③×3+②可得XeF4与水反应的总方程式:6XeF4+12H2O→4Xe↑+3O2↑+2XeO3+24HF ④
n(O2)=$\frac{PV({O}_{2})}{RT}$=$\frac{1.00×1{0}^{5}×24.1×1{0}^{-6}}{8.31×290}$=1.00×10-3mol,
n(总)=$\frac{1.00×1{0}^{5}×60.2×1{0}^{-6}}{8.31×290}$=2.50×10-3mol,
则Xe的物质的量为:2.50×10-3mol-1.00×10-3mol=1.50×10-3mol,
设原固体中含有XeF2的物质的量为x、XeF4的物质的量为y,
根据①④可知生成Xe的物质的量可得:n(Xe)=x+$\frac{2}{3}$y=1.50×10-3mol,生成的氧气为:n(O2)=$\frac{x}{2}$+$\frac{y}{2}$=1.00×10-3mol,
二者联立解得:x=0.500×10-3mol、y=1.50×10-3mol,
所以原固体混合物中XeF4的物质的量分数是:$\frac{1.5×1{0}^{-3}mol}{1.5×1{0}^{-3}mol+0.50×1{0}^{-3}mol}$=0.25,
则原固体混合物中XeF2的物质的量分数是:1-0.25=0.75,
故答案为:0.25或25%;
(2)原溶液中n(SO42-)=n(BaCl2)=0.4L×4mol/L=1.6mol,
假设原溶液中只有CuSO4,由Fe+Cu2+=Cu+Fe2+可知,则参加反应的n(Fe)=n(CuSO4)=1.6mol,反应的铁粉质量为:1.6mol×56g/mol=89.6g,
假设原溶液中只有Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4可知,则参加反应的n(Fe)=1.6mol×$\frac{1}{3}$,反应的铁粉质量为:1.6mol×$\frac{1}{3}$×56g/mol=22.9g,
所以21.7g铁粉会完全反应,没有剩余,最后得到16.8g残留固体为铜,
Fe+CuSO4=FeSO4+Cu
56 64
m(Fe) 16.8g
m(Fe)=$\frac{16.8g×56}{64}$=14.7g
与Fe2(SO4)3反应的铁粉质量为:21.7g-14.7g=7g,
Fe+Fe2(SO4)3=3FeSO4
56g 1mol
7g n[Fe2(SO4)3]
所以 n[Fe2(SO4)3]=$\frac{7g×1mol}{56}$=0.125mol,
根据硫酸根守恒,则n(CuSO4)=1.6mol-0.125mol×3=1.225mol,
则c(CuSO4)=$\frac{1.225mol}{0.5L}$=2.45mol/L,
故答案为:2.45.
点评 本题考查了混合物反应的计算,题目难度较大,难点、易错点为(1),根据题中信息正确书写出反应的化学方程式为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 洗涤沉淀时,应在过滤器中加入洗涤液浸没沉淀,过滤,并重复2到3次 | |
| C. | 抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶支管口倒出 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B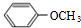 ,C
,C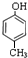 .
. ,②
,②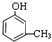 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
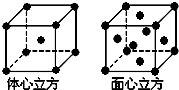 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
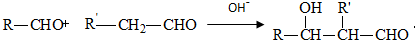 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下: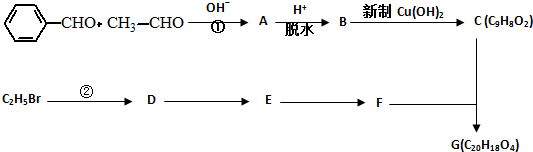
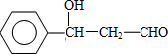 ;F的结构简式:CH2OHCH2OH;
;F的结构简式:CH2OHCH2OH; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||||
| B. | AlCl3溶液与烧碱溶液反应,当 n(OH-):n(Al3+ )=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||||
| C. | 钠与CuSO4溶液反应,2Na+Cu2+═Cu↓+2Na+ | ||||||||
| D. | 已知碳酸和次氯酸的电离平衡常数如下:
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,N2的转化率能达到100% | |
| D. | 达到平衡时,N2、H2和NH3的浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com