
| A. | 用量筒测得排水法收集制得的氢气体积为5.28 mL | |
| B. | 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液 | |
| C. | 用托盘天平称得2.50g胆矾,受热充分失水后,固体质量减轻0.90g | |
| D. | 常温下,测得1molN2的质量为28g |
科目:高中化学 来源: 题型:选择题
| A. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变小 | |
| B. | 常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 | |
| C. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 | |
| D. | 已知,K=$\frac{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}{{c}^{3}({H}_{2}O)•c(C{H}_{3}C{H}_{2}OH)}$则对应的化学反应可以表示为:CH3CH2OH(g)+3H2O(g)?2CO2( g)+6H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
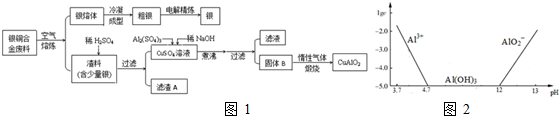
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
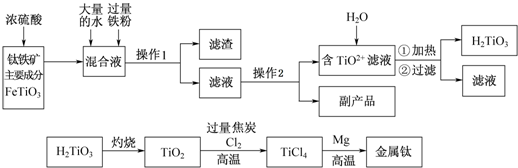
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

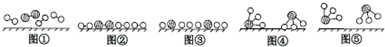
 、
、 、
、 分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂
分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂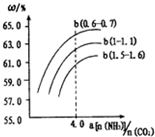
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

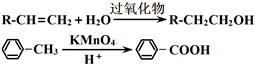

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com