
分析 (1)氢氧化钠与可溶性铁盐反应生成氢氧化铁,氢氧化铁为红褐色沉淀;
(2)氢氧化钠与可溶性亚铁盐反应生成氢氧化亚铁,氢氧化铁为白色沉淀;
(3)氢氧化钠与可溶性铜盐反应生成氢氧化铜,氢氧化铜为蓝色沉淀;
(4)氨水与可溶性铝盐反应生成氢氧化铝,氢氧化铝为白色沉淀.
解答 解:(1)氢氧化钠与Fe2(SO4)3或FeCl3反应生成氢氧化铁,氢氧化铁为红褐色沉淀,离子方程式:Fe3++3OH-=Fe(OH)3↓;
故答案为:Fe2(SO4)3或FeCl3;红褐; Fe3++3OH-=Fe(OH)3↓;
(2)氢氧化钠与可溶性FeSO4或FeCl2反应生成氢氧化亚铁,氢氧化铁为白色沉淀,离子方程式:Fe2++2OH-=Fe(OH)2↓;
故答案为:FeSO4或FeCl2;白色;Fe2++2OH-=Fe(OH)2↓;
(3)氢氧化钠与CuSO4或CuCl2反应生成氢氧化铜,氢氧化铜为蓝色沉淀,离子方程式:Cu2++2OH-=Cu(OH)2↓;
故答案为:CuSO4或CuCl2;蓝色;Cu2++2OH-=Cu(OH)2↓;
(4)氨水与Al2(SO4)3或AlCl3反应生成氢氧化铝,氢氧化铝为白色沉淀,离子方程式:Al3++3OH-=Al(OH)3↓;
故答案为:Al2(SO4)3或AlCl3;白色;Al3++3OH-=Al(OH)3↓;
点评 本题考查了离子方程式的书写,明确复分解反应条件是解题关键,题目难度不大,注意制备氢氧化铝应用氨水,不能使用氢氧化钠.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 化合价 | -2 | -3 | -4 | -3 |
| A. | 含氧酸的酸性:乙<丁 | B. | 元素非金属性:甲<乙 | ||
| C. | 丙所形成的单质可能互为同位素 | D. | 氢化物的沸点:甲>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
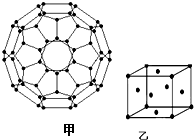 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
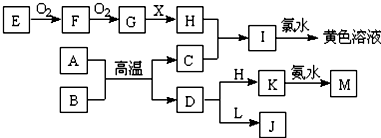
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
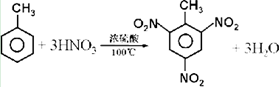 .
.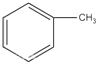 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$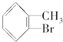 +HBr或
+HBr或 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$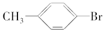 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3与BaSO4沉淀 | B. | BaSO3沉淀 | ||
| C. | BaSO4沉淀 | D. | 无法得到沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
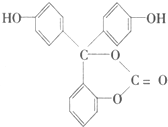
| A. | 6mol | B. | 5mol | C. | 4mol | D. | 2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com