
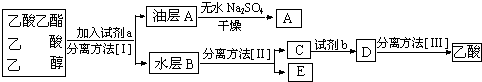
分析 (1)实验中加热液体可能发生暴沸,需要加入碎瓷片;
(2)过量乙醇可促进乙酸反应,平衡正向进行;
(3)由实验流程可知,a为饱和碳酸钠溶液,分离方法I为分液,则油层A为乙酸乙酯,干燥得到A为乙酸乙酯;水层B含乙酸钠、碳酸钠、乙醇,分离方法II为蒸馏,得到E为乙醇,C中含乙酸钠、碳酸钠,试剂b为硫酸,D中含硫酸钠、乙酸,分离方法Ⅲ为蒸馏,以此来解答.
解答 解:(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入碎瓷片,目的是防止暴沸,
故答案为:碎瓷片;
(2)反应中加入过量的乙醇,目的是提高乙酸的转化率,故答案为:提高乙酸的转化率;
(3)由实验流程可知,a为饱和碳酸钠溶液,分离方法I为分液,则油层A为乙酸乙酯,干燥得到A为乙酸乙酯;水层B含乙酸钠、碳酸钠、乙醇,分离方法II为蒸馏,得到E为乙醇,C中含乙酸钠、碳酸钠,试剂b为硫酸,D中含硫酸钠、乙酸,分离方法Ⅲ为蒸馏,
故答案为:饱和Na2CO3溶液;分液;蒸馏;硫酸;蒸馏.
点评 本题考查有机物的制备及混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下: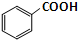 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 物质 | 颜色状态 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
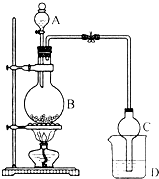 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低体系温度能加快该反应的速率 | |
| B. | 0~2S内用O2表示该反应的平均反应速率为0.15mol/(L•s) | |
| C. | 增大SO3的浓度能减慢该反应速率 | |
| D. | 反应一段时间后可生成4molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 金属阳离子 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | HF |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=6.75×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
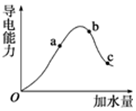 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、Fe3+、OH-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Ca2+、Mg2+、HCO3-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com