
【题目】NaCl样品中混有少量的CaCl2和NaBr,按下列程序操作可制得纯净的NaCl.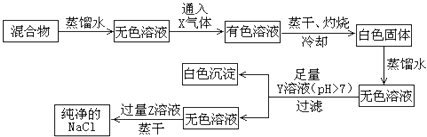
(1)X气体是 , Y溶液是 , Z溶液是 .
(2)过滤时,除漏斗外还需要的玻璃仪器有 .
(3)加入Y溶液的目的是;若在不使用pH试纸的情况下,检验Y溶液是否足量的方法是(简要回答操作过程及现象) .
【答案】
(1)Cl2;Na2CO3;盐酸
(2)烧杯、玻璃棒
(3)使溶液中的Ca2+形成CaCO3沉淀;过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的
【解析】解:混合物溶于水,通入气体X可得有色溶液,说明生成溴,则X为Cl2 , 将溶液蒸干、灼烧得到白色固体含有氯化钠、氯化钙,加入蒸馏水溶解,然后加入足量的Y溶液,生成白色 沉淀,Y溶液的pH>7,应为Na2CO3 , 可与氯化钙反应生成CaCO3沉淀,滤液中加入过量盐酸,蒸干可得氯化钠,(1)由以上分析可知X为Cl2 , Y为Na2CO3 , Z为盐酸,所以答案是:Cl2;Na2CO3;盐酸;(2)过滤时,除漏斗外还需要的玻璃仪器有烧杯、玻璃棒,所以答案是:烧杯、玻璃棒;(3)混合物中含有氯化钙,加入碳酸钠,可使氯化钙生成沉淀,若在不使用pH试纸的情况下,检验Y溶液是否足量的方法是过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的,所以答案是:使溶液中的Ca2+形成CaCO3沉淀;过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8g CO2和3.6gH2O;E的蒸气对氢气的相对密度为30,则E的分子式为 .
(2)A为一取代芳烃,B中含有一个甲基.由B生成C的化学方程式为 .
(3)由B生成D、由C生成D的反应条件分别是、 .
(4)由A生成B、由D生成G的反应类型分别是、 .
(5)F存在于栀子香油中,其结构简式为 .
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有种,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是 ![]() 和
和 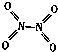 .实验测得N﹣N键的键能为167kJmol﹣1 , NO2中氮氧键的键能为 466kJmol﹣1 , N2O4中氮氧键的键能为438.5kJmol﹣1 .
.实验测得N﹣N键的键能为167kJmol﹣1 , NO2中氮氧键的键能为 466kJmol﹣1 , N2O4中氮氧键的键能为438.5kJmol﹣1 .
(1)写出N2O4转化NO2为的热化学方程式 .
(2)对反应N2O4(g)2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.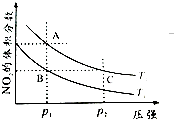
①A、C两点的反应速率v(A)v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是 .
④A点气体的颜色比C点(填“深”、“浅”或“相同”),原因是 .
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,v(NO2)=molL﹣1s﹣1 .
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图如右图所示: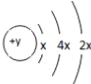 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为_______,其气态氢化物的化学式为________。
(2)D离子的离子结构示意图为__________________。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为_______________________(用元素符号比较)
(4)B的最高价氧化物的水化物与A的氢化物的水溶液反应的离子方程式式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( ) 
A.图1中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
B.图2中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
C.图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2,并进行相关探究活动。
(已知:酸性强弱为H2SO3>H2CO3>HClO)
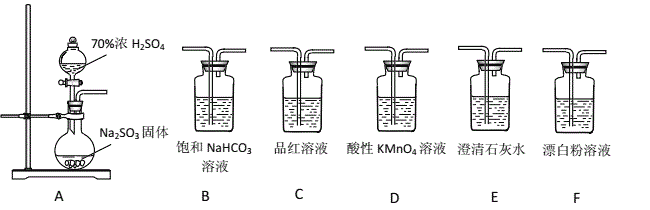
(1)装置A中反应的化学方程式为_________________________________________。
(2)甲同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到了C、D装置。
①C装置的作用是___________________________。
②通过___________________________________________________(填实验现象)即可证明亚硫酸酸性强于碳酸。
(3)乙同学认为利用上述装置也可以证明亚硫酸的酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) → C → F 。____________
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
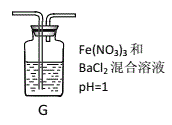
I.推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3-氧化;
原因二:SO2被Fe3+氧化;
原因三:_____________________________________________。
II.如果丙同学认为是因为“原因二”产生了白色沉淀。
①请你写出SO2被Fe3+氧化的离子方程式:_________________________________
②假如Fe3+恰好完全反应,请你设计实验证明其还原产物,并简要叙述实验过程、现象及结论。
___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:M+N﹣→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81min,将温度提高到30℃时,完成反应的10%需要的时间为( )
A.9 min
B.27 min
C.13.5 min
D.3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 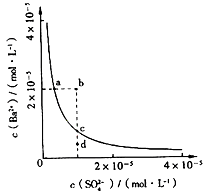
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com