
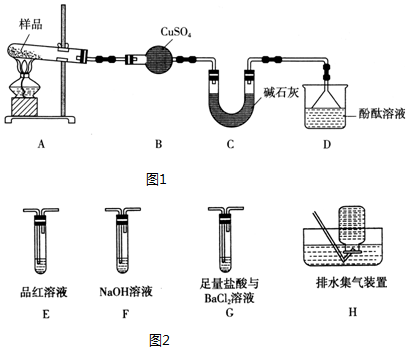
分析 (1)装置B无水硫酸铜是检验分解产物水;
(2)碱石灰的主要作用是吸收分解产生的酸性气体;
(3)装置D中观察到酚酞溶液变红色,说明有碱性气体产生;
(4)利用二价铁离子具有还原性设计实验检验;
(5)要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,据此答题;由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰;
(6)根据以上分析,测得装置A中固体残留物即氧化铁的质量为1.6000g,则n(Fe2O3)=$\frac{1.6000g}{160g/mol}$=0.01mol,装置G中生成白色沉淀即硫酸钡的质量为3.4950g,则根据氯化钡溶液检验SO3及硫原子守恒,所以n(SO3)=$\frac{3.495}{233}$=0.015mol,装置H中收集到112mL N2(标准状况下)即$\frac{0.112}{22.4}$=0.005mol,根据得失电子守恒,则生成二氧化硫的物质的量为:$\frac{0.005×2×3+0.01×2}{2}$=0.025mol,所以生成物中Fe2O3:SO3:SO2:N2=2:3:5:1;结合原子守恒书写方程式.
解答 解:(1)装置B无水硫酸铜是检验分解产物水,所以看到的现象为白色固体变蓝色,故答案为:白色固体变蓝色;
(2)碱石灰的主要作用是吸收分解产生的酸性气体,故答案为:吸收分解产生的酸性气体;
(3)装置D中观察到酚酞溶液变红色,说明有碱性气体产生即NH3,所以由此可知摩尔盐分解的产物中有NH3;故答案为:NH3;
(4)利用二价铁离子具有还原性设计实验检验,实验设计为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,证明此固体产物不含FeO,
故答案为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,说明此固体产物不含FeO;
(5)要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、E、F、H,由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰;
故答案为:G、E、F、H;吸收氨气并将溶液酸化,排除SO2的干扰;
(6)根据以上分析,测得装置A中固体残留物即氧化铁的质量为1.6000g,则n(Fe2O3)=$\frac{1.6000g}{160g/mol}$=0.01mol,装置G中生成白色沉淀即硫酸钡的质量为3.4950g,则根据氯化钡溶液检验SO3及硫原子守恒,所以n(SO3)=$\frac{3.495}{233}$=0.015mol,装置H中收集到112mL N2(标准状况下)即$\frac{0.112}{22.4}$=0.005mol,根据得失电子守恒,则生成二氧化硫的物质的量为:$\frac{0.005×2×3+0.01×2}{2}$=0.025mol,所以生成物中Fe2O3:SO3:SO2:N2=2:3:5:1;所以根据原子守恒,摩尔盐受热分解的化学方程式为:4[(NH4)2Fe(SO4)2•6H2O]$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O,故答案为:4[(NH4)2Fe(SO4)2•6H2O]$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O.
点评 本题考查了物质性质、物质分解产物的实验验证,注意检验实验设计应避免干扰验,试剂选择和反应现象的理解应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱用于制造玻璃 | B. | 医药上用小苏打治疗胃酸过多 | ||
| C. | 打磨磁石制指南针 | D. | 工业上利用合成氨实现人工固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酶是具有催化功能的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或紫外线的照射会降低酶的活性 | |
| D. | 酶通常在强酸或强碱的条件下发挥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| C. | 将CO2气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com