
| A. | 食盐 | B. | 白醋 | C. | 小苏打 | D. | 烧碱 |
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、范德华力 | B. | 范德华力、范德华力、共价键 | ||
| C. | 范德华力、共价键、共价键 | D. | 共价键、共价键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、Na+、HCO3- | B. | CO32-、K+、Na+ | C. | Na+、SO42-、C1- | D. | NH4+、Fe3+、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
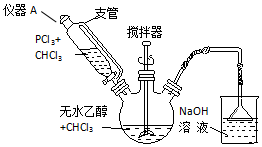
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.1 mol/(L•min) | B. | v(NH3)=0.2 mol/(L•min) | ||
| C. | v(H2)=0.3 mol/(L•min) | D. | v(H2)=0.4 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
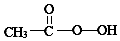 )常用作纺织品漂白剂.
)常用作纺织品漂白剂.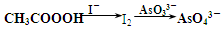
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体带电荷,溶液不带电荷 | |
| B. | 胶体区别于其它分散系的本质特征是分散质的直径大小 | |
| C. | 将一柬光线通过胶体时可出现一条光亮的通路,通过溶液则没有此现象 | |
| D. | 土壤胶粒的表面巨大且带负电,能吸附NH${\;}_{4}^{+}$等营养离子,使土壤具有保肥能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCaCl2溶液中含Cl-数为0.4NA | |
| B. | 标准状况下,1.12L H2S气体分子中含0.5NA个质子 | |
| C. | 常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | 标准状况下,4.48L的水中含有H2O分子的数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com