
【题目】下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
⑴ A的化学式是____________;
⑵ 反应F→D的化学方程式是______________________________________。
⑶ 检验F中金属阳离子的常用方法是___________________________________。
⑷ 物质B与盐酸反应的离子方程式是_________________________________。
【答案】 Al 2FeCl3+Fe=3FeCl2 用KSCN溶液,若溶液变红色 Fe+2H+=Fe2++H2↑
【解析】B是常见的金属,且B的合金用量最大,B为Fe,由B+盐酸→D+H2 可知,D为FeCl2 ,E在常温下是黄绿色气体,E为Cl2 ,FeCl2 与Cl2 反应生成FeCl3 ,F为FeCl3 ,FeCl3 溶液可以与Fe反应生成FeCl2 ,符合转化关系;
A是常见的金属,由A+盐酸→C+H2 ,C为金属氯化物,C与氢氧化钠反应生成白色沉淀,可以溶于氢氧化钠、盐酸,故该白色沉淀为Al(OH)3 ,故C为AlCl3 ,A为Al,
⑴ A的化学式是Al;(2)反应F→D是FeCl3 生成FeCl2 的反应,反应的化学方程式是:2FeCl3+Fe=3FeCl2 ,故答案为:2FeCl3 +Fe=3FeCl2 ;(3)检验F中金属阳离子是Fe3+,检验的常用方法是:取溶于少许于试管中,加入KSCN溶液,溶液变为血红色溶液,证明是三价铁离子的存在,故答案为:加入KSCN溶液,溶液呈血红色则含Fe3+ ; ⑷ B为Fe,由B+盐酸→D+H2 可知,D为FeCl2 ,物质B与盐酸反应的离子方程式是Fe+2H+=Fe2++H2↑。


科目:高中化学 来源: 题型:
【题目】硫酸工业是我国化工生产支柱产业。主要生产工艺流程如下:

接触室中的反应为2SO2(g)+O2(g)![]() 2SO3(g) H=197 kJ·mol1。
2SO3(g) H=197 kJ·mol1。
请回答以下几个问题:
(1)图中炉气要净化的原因是_____________________________________。
(2)吸收塔排出的尾气先用足量的氨水吸收,反应的离子方程式为_______________,再用浓硫酸处理,得到较高浓度的SO2和铵盐。所得的SO2可用于工业制溴过程中吸收潮湿空气中的Br2,吸收Br2的过程中主要反应的化学方程式是____________________________________。所得铵盐溶液中各离子物质的量浓度由大到小的顺序为________________________。
(3)为什么从接触室出来的SO3气体不用水直接吸收,而是用98.3%的浓硫酸吸收:____________________。
![]() (4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
(4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
A.通入过量的空气 B.使用优质催化剂
C.调整适宜的温度 D.采用高压
(5)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图。为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某有机物由C、H、O三种元素组成,球棍模型如图所示:

(1)该有机物的分子式是_____________;
(2)该有机物可以发生加聚反应,其产物的结构简式是_____________;
(3)下列有关该有机物的描述中,正确的是____(填序号)。
a. 能与NaHCO3溶液反应
b. 能发生水解反应
c. 不能与溴的CCl4溶液反应
d. 能与酸性高锰酸钾溶液反应
II. (1)写出下列化合物的名称或结构简式:
①![]() _______________________________,
_______________________________,
②2,5-二甲基-2,4-己二烯的结构简式:_______________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如图:

麻黄素中含氧官能团的名称是_________________,属于____________类(填“醇”或“酚”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如图实验:

现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的![]() 置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是__________________________________。
(2)装置a和c的作用分别是________和________(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)滴定达终点时的现象是_________________________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_______________________。
(5)通过计算可知,该黄铜矿的纯度为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
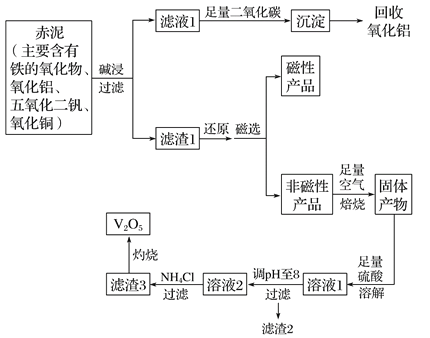
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
实验要求 | 化学试剂 |
检验酒精中是否有水 | _____ |
区别CH4和C2H4两种无色气体 | _____ |
验证味精是否有食盐 | _____ |
除去Fe2O3中的Al2O3 | _____ |
供选择的化学试剂:
A.酸性高锰酸钾 B.硝酸银溶液和硝酸 C.氢氧化钠溶液 D.无水硫酸铜粉末
⑵红热木炭与浓H2SO4反应的化学方程式是 C+2H2SO4 ![]() CO2↑+2SO2↑+2H2O ,该反应中浓硫酸的作用是___________________。按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2。已知图中4个洗气瓶均装有检测液。现给出4种溶液①品红溶液②酸性高锰酸钾溶液③品红溶液④澄清石灰水。试回答下列问题。
CO2↑+2SO2↑+2H2O ,该反应中浓硫酸的作用是___________________。按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2。已知图中4个洗气瓶均装有检测液。现给出4种溶液①品红溶液②酸性高锰酸钾溶液③品红溶液④澄清石灰水。试回答下列问题。

第一个洗气瓶中品红溶液褪色,体现了二氧化硫具有________________性。
第一个洗气瓶的作用是______________________________________________。
第二个洗气瓶中高锰酸钾溶液褪色,体现了二氧化硫具有______________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是( )
A. 每生成1 mol N2转移的电子的物质的量为6 mol
B. N2既是氧化剂,又是还原剂
C. NH4Cl中的氮元素被还原
D. NaNO2是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com