
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H4和NO | ||
| C. | 同温度同压强的CO和N2 | D. | 同体积同压强的N2和N2H4 |
分析 A.CO和C2H4的摩尔质量相同,二者质量相同,则物质的量相同,分子数目之比等于物质的量之比;
B.同温度、同体积的C2H4和NO,影响二者物质的量的因素有压强,二者的压强不一定相同;
C.同温度同压强的CO和N2,具有相同的气体摩尔体积,而二者的体积不一定相等;
C.同压强、同体积的N2和N2H4,影响二者物质的量的因素有温度,二者的温度不一定相同.
解答 解:A.CO和C2H4的摩尔质量相同,二者质量相同,根据n=$\frac{m}{M}$可知,二者的物质的量相同,则二者含有分子数目相等,故A正确;
B.同温度、同体积的C2H4和NO,影响二者物质的量的因素有压强,二者的压强若相等,含有相同的分子数目,但二者压强不一定相同,含有分子数目不一定相等,故B错误;
C.同温度同压强的CO和N2,二者的气体摩尔体积相同,则二者的分子数取决于气体体积,没有告诉体积是否相等,则二者的分子数不一定相等,故C错误;
D.N2和N2H4,影响二者物质的量的因素有温度,二者的温度若相等,含有相同的分子数目,但二者温度不一定相同,所以含有分子数目不一定相等,故D错误;
故选A.
点评 本题考查了阿伏伽德罗定律及其推论,题目难度中等,明确各个物理量之间的关系是解本题关键,知道只有物质的量相等时其分子数才能相等,只要判断气体的物质的量是否相等即可.


科目:高中化学 来源: 题型:解答题
| 熔点/K | 沸点/K | 水中的溶解度(标准状况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
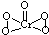 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①② | C. | ②④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg为电池的负极 | B. | 正极反应为:AgCl+e-═Ag+Cl- | ||
| C. | 不能被KCl 溶液激活 | D. | 可用于海上应急照明供电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷(乙炔):通过盛溴水的洗气瓶 | |
| B. | 乙酸乙酯(乙醇):加入乙酸和浓硫酸的混合液,然后加热 | |
| C. | 苯(苯酚):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入生石灰,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
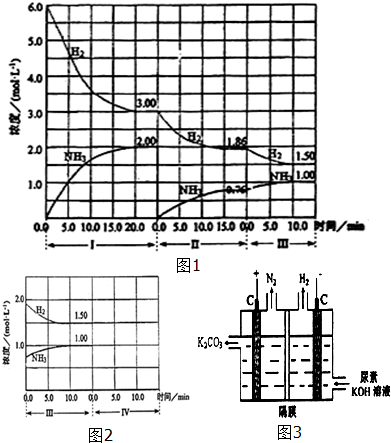
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
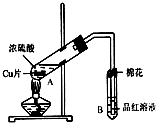 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com