
分析 根据已知热化学方程式和盖斯定律计算,由盖斯定律①×2-②×2+③×3得得到反应的焓变,写出对应反应的热化学方程式.
解答 解:(1)N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol ①
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol ②
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol ③
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol;
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
点评 本题主要考查了盖斯定律的应用知识,掌握基础是关键,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| A | 2080 | 4000 | 6100 | 9400 |
| B | 500 | 4600 | 6900 | 9500 |
| C | 740 | 1500 | 7700 | 10500 |
| D | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
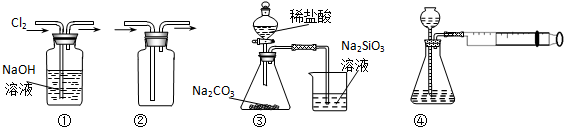
| A. | 装置①可用于除去Cl2中含有的少量HCl气体 | |
| B. | 装置④向左推动针筒活塞可检验该装置的气密性 | |
| C. | 装置③可证明非金属性Cl>C>Si | |
| D. | 按装置②所示的气流方向可用于收集H2、NH3等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 0.1molCu与足量的浓硫酸反应生成SO2的体积为2.24L | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 反应Cl2+2NaOH=NaCl+NaClO+H2O中,每消耗1molCl2转移电子数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②④⑤⑥ | C. | ⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:| A. | 放电时:电子流动方向由A经导线流向B | |
| B. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| C. | 放电时:当电路中转移0.2mol电子时,消耗的H2SO4 0.4mol | |
| D. | 放电时:外电路通过1mol电子时,理论上负极板的质量增加48g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 元素X和元素W最高正价代数和一定为8 | |
| B. | 若元素X的原子序数为a,则Z的原子序数一定为a+9. | |
| C. | 常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 | |
| D. | 原子半径的大小顺序为rW>rZ>rX>rY. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 0.5mol/L MgCl2溶液 | B. | 200ml 0.25mol/L HCl溶液 | ||
| C. | 50ml 1mol/L NaCl溶液 | D. | 200ml 0.25mol/L CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com