
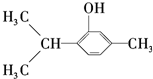
 )用于制香料、药物和指示剂等,下列说法正确的是( )
)用于制香料、药物和指示剂等,下列说法正确的是( )| A. | 百里酚的分子式为C10H16O | |
| B. | 百里酚可与氯化铁发生显色反应 | |
| C. | 百里酚分子中所有碳原子可以在同一平面上 | |
| D. | 百里酚既可与盐酸反应,又可与氢氧化钠溶液反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A.将盐卤或石膏加入豆浆中,制成豆腐
B.冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C.泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用
D.胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C12与水反应 C12+H2O═2 H++C1-+ClO- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与足量盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
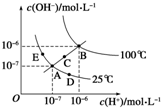
| A. | 图中五点Kw的关系:B>C>A=D=E | |
| B. | 若从A 点到D 点,可采用:温度不变向水中加入少量的酸 | |
| C. | 若从A 点到C 点,可采用:温度不变向水中加入适量的NH4Cl 固体 | |
| D. | 若处在B 点时,将pH=2 的硫酸与pH=10 的KOH 溶液等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
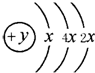 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C2或B2C据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C2或B2C据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 原子半径按X、Y、Z的顺序减小 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj•mol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:简答题
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJ/mol、-283.0kJ/mol和-726.5kJ/mol。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:___________________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
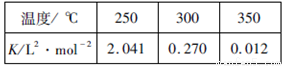

①该反应的平衡常数的表达式是____________,由表中数据判断△H_________0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为____________,则反应速率v(H2)=_____________。
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g) CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的½,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的½,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物 质的量浓度随时间变化的趋势示意图(其他条件不变,曲
质的量浓度随时间变化的趋势示意图(其他条件不变,曲 线上必须标明氢气、甲醇)。
线上必须标明氢气、甲醇)。
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的 电极反应式________________________。
电极反应式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com