

 .分别写出②和⑦、③和⑧化合产物的电子式
.分别写出②和⑦、③和⑧化合产物的电子式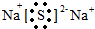 、
、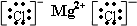 .⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).
.⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).分析 由元素在周期表中的位置可知,①为H,②为Na,③为Mg,④为Al,⑤为C,⑥为N,⑦为S,⑧为Cl,⑨为Ar,⑩为K,然后利用元素及其单质、化合物的性质来解答.
解答 解:(1)由元素在周期表中的位置可知,⑤为C,名称为碳,
故答案为:碳;C;
(2)在已经发现的3000多万种物质中,有机物占90%以上,有机物是含有碳元素的化合物,所以从①--⑩各元素中,形成化合物种类最多的元素是碳元素,同周期从左向右元素的金属性减弱、非金属性增强,同主族从上到下元素的金属性增强、非金属性减弱,上述元素中K的金属性最强,Cl的非金属性最强,稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,
故答案为:C;K;Cl;Ar;
(3)②位于第三周期第ⅠA族,为Na元素,对应的最高价氧化物的水化物为NaOH,为强碱,④是两性氧化物的元素是铝元素,铝的最高价氧化物对应的水化物是氢氧化铝,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)①为H,⑧为Cl,两种元素的单质混合在光照下能化合生成氯化氢,氯化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为: ,②和⑦化合产物为硫化钠,是钠离子和硫离子形成的离子化合物,硫化钠的电子式为:
,②和⑦化合产物为硫化钠,是钠离子和硫离子形成的离子化合物,硫化钠的电子式为: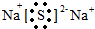 ,③和⑧化合产物为氯化镁,是离子化合物,由氯离子和镁离子构成,氯化镁电子式为
,③和⑧化合产物为氯化镁,是离子化合物,由氯离子和镁离子构成,氯化镁电子式为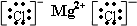 ,非金属性越强,气态氢化物越稳定,⑤为C,⑥为N,非金属性N>C,则气态氢化物的稳定性:NH3>CH4,元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;同一周期元素,其非金属性随着原子序数增大而增强,⑦为S,⑧为Cl,所以酸性HClO4>H2SO4,
,非金属性越强,气态氢化物越稳定,⑤为C,⑥为N,非金属性N>C,则气态氢化物的稳定性:NH3>CH4,元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;同一周期元素,其非金属性随着原子序数增大而增强,⑦为S,⑧为Cl,所以酸性HClO4>H2SO4,
故答案为: ;
;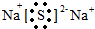 ;
;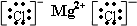 ;NH3>CH4;HClO4>H2SO4;
;NH3>CH4;HClO4>H2SO4;
(5)1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,
故答案为:俄;门捷列夫.
点评 本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置及元素、化合物的性质是解答本题的关键,题目难度中等,注意化学用语的使用来解答.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:实验题
 如图为原电池装置示意图:
如图为原电池装置示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4 L苯所含的分子数为NA | |
| B. | 0.1 mol/L NaOH溶液所含的Na+数为0.1NA | |
| C. | 在常温常压下,11.2 L CH4所含的氢原子数为2NA | |
| D. | 在标准状况下,14 g氮气所含的核外电子数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液 饱和溴水 | B. | 碳酸钠溶液 饱和溴水 | ||
| C. | 酸性高锰酸钾溶液 饱和溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ①②⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 根据题意回答下列问题
根据题意回答下列问题 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com