
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
分析 A.△H-T△S<0的反应能够自发进行;
B.△H的大小与热化学方程式的计量系数成正比;
C.将碱溶液分多次缓慢加入酸溶液中,导致热量散失较多;
D.Zn、Fe和电解质溶液接触能形成原电池,Zn作负极,Fe作正极.
解答 解:A.CaCO3(s)═CaO(s)+CO2(g)反应的△S>0,室温下不能自发进行,说明△H-T△S>0,所以该反应的△H>0,故A错误;
B.一个化学反应的△H与实际参加化学反应的物质的多少无关,而△H的大小与热化学方程式的计量系数成正比,即△H与热化学方程式的计量系数有关,故B正确;
C.将碱溶液分多次缓慢加入酸溶液中,导致热量散失较多,测定的中和热的值偏小,所以应该一次加入,故C错误;
D.Zn、Fe和电解质溶液接触能形成原电池,Zn失电子作负极,被腐蚀,Fe作正极被保护,属于牺牲阳极的阴极保护法,属于原电池原理,故D错误.
故选B.
点评 本题考查了反应自发性的判断、反应热与计量数的关系、中和热的测定、金属的电化学腐蚀与防护等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 | B. | 36 | C. | 64 | D. | 48 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:
A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |

| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
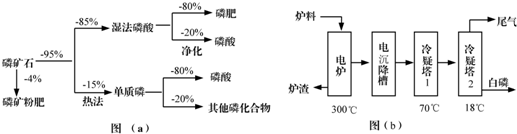
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
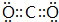 ;C2B2所含化学键为离子键、共价键.
;C2B2所含化学键为离子键、共价键.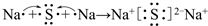 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com