
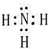 ,丁中所包含的化学键类型有bc(填字母序号).
,丁中所包含的化学键类型有bc(填字母序号).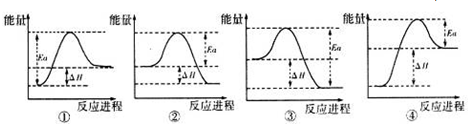
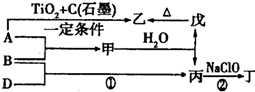
分析 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,则戊为Al(OH)3;结合转化关系图可知,乙为Al2O3,A为Al,B为N2,甲为氮化铝,D为H2,据此解答.
解答 解:A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,则戊为Al(OH)3;结合转化关系图可知,乙为Al2O3,A为Al,B为N2,甲为氮化铝,D为H2.
(1)A中元素为Al,在元素周期表中的位置:第三周期ⅢA族,A、B单质对应元素的简单离子分别为Al3+、N3-,二者电子层结构相同,核电荷数越大离子半径越小,故离子半径由大到小的顺序为 N3->Al3+,
故答案为:第三周期ⅢA族;N3->Al3+;
(2)丙为NH3,电子式为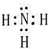 ,丁为N2H4,所包含的化学键类型有极性共价键、非极性共价键,
,丁为N2H4,所包含的化学键类型有极性共价键、非极性共价键,
故答案为: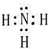 ;bc;
;bc;
(3)甲和水反应生成戊和丙的化学方程式为:AlN+3H2O═Al(OH)3↓+NH3↑,
故答案为:AlN+3H2O═Al(OH)3↓+NH3↑;
(4)发生反应:4Al+3TiO2+3C(石墨)=2Al2O3+3TiC,反应生成1mol乙(氧化铝)时放出536kJ热量,则该反应热化学方程式为:4Al(s)+3TiO2(s)+3C(s石墨)=2Al2O3(s)+3TiC(s)△H=-1072KJ/mol,
故答案为:4Al(s)+3TiO2(s)+3C(s石墨)=2Al2O3(s)+3TiC(s)△H=-1072KJ/mol;
(5)另有物质己为中学常见黑色磁性氧化物,则己为Fe3O4,Al与四氧化三铁发生铝热反应,放出大量的热,高出反应物能量的那部分能量为活化能,图象中②符合,
故答案为:②;
(6)物质Fe3O4可用于除去地下水中的TcO4-(99Tc具有放射性).在弱酸性条件下,物质Fe3O4将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该弱碱为Fe(OH)3,该反应的离子方程式为:3Fe3O4+TcO4-+H++13H2O=TcO2+9 Fe(OH)3 ,
故答案为:3Fe3O4+TcO4-+H++13H2O=TcO2+9 Fe(OH)3 .
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,丙、戊为推断的突破口,需要学生熟练掌握元素化合物性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
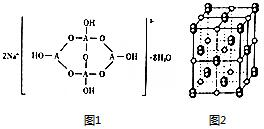 已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.
已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和. .
.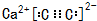 ,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).
,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
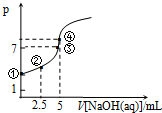 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )| A. | 水电离出的c(OH-):①点小于 ③点 | |
| B. | 此反应的滴定实验宜选用甲基橙做指示剂 | |
| C. | ②点时c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) | |
| D. | ④点时c(Na+)=c(N3-)+c(HN3)=$\frac{1}{15}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| B. | $\frac{{k}_{W}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:NH4+、Na+、SiO32-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊溶液呈红色的溶液中:Na+、SO42-、Fe3+、MnO4-可以大量共存 | |
| B. | NA代表阿伏加德罗常数的数值,1 mol硫酸氢钾晶体中阳离子所带电荷总数为NA | |
| C. | 235U与238U的相互转化不是化学变化 | |
| D. | 元素O、S、P的气态氢化物热稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的秸秆、枝叶、杂草和人畜粪便等生物质在沼气池中经发酵可生成沼气 | |
| B. | Al(OH)3、Fe(OH)3等胶体具有很强的吸附能力,可用于净水 | |
| C. | 鸡蛋清中加入浓食盐水析出沉淀、75%乙醇溶液进行消毒、福尔马林用于浸制生物标本,其中蛋白质都发生了变性 | |
| D. | 塑料袋、废纸、旧橡胶制品等属于有机物,可以回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
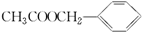 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: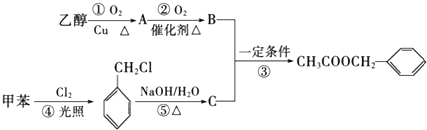
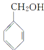 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基.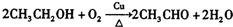 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com