
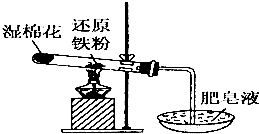
 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.分析 (1)湿棉花能提供反应所需的水蒸气;
(2)在加热条件下,Fe与水蒸气反应生成四氧化三铁和氢气;
(3)有爆鸣声,说明有可燃性气体生成,结合元素守恒分析.
解答 解:(1)在加热条件下,湿棉花转化的水受热形成水蒸气,提供反应所需的水蒸气;
故答案为:提供水蒸汽;
(2)在加热条件下,Fe与水蒸气反应生成四氧化三铁和氢气,其反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(3)有爆鸣声,说明有可燃性气体生成,由于反应物为Fe和水蒸气,所以生成的可燃性气体为H2;
故答案为:H2.
点评 本题考查了Fe与水蒸气的反应,把握实验原理以及氢气的检验方法是解题的关键,侧重于考查学生的分析能力,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:实验题
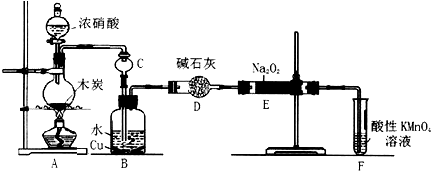
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧; | 若溶解氧不同的两份溶液中,测出的砷的浓度不同,则溶解氧对砷的去除效率有影响;反之则无影响. |
| ②向上述两份溶液中投入足量等质量的同种单质铁 | |
| ③相同一段时间后,用分光光度计测定两份水样中砷的浓度 |
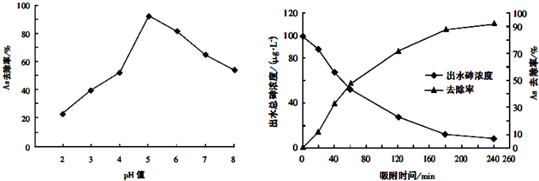
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
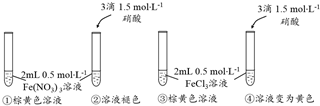
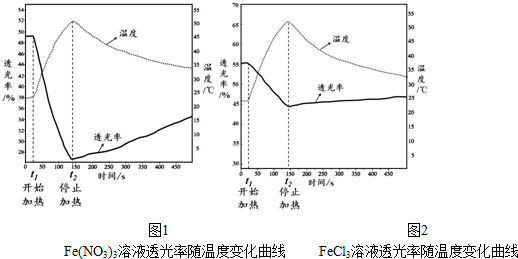
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
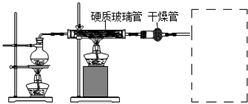
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
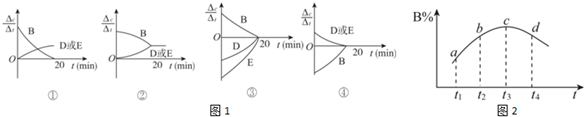
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H1,△H4>△H3 | B. | △H1>△H2,△H4>△H3 | C. | △H1>△H2,△H3>△H4 | D. | △H2>△H1,△H3>△H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com