
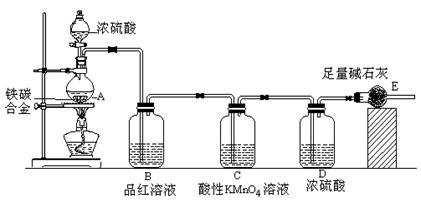
 CO2↑ + 2SO2↑ + 2H2O(2分)
CO2↑ + 2SO2↑ + 2H2O(2分) CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O, g,则铁的质量分数:
g,则铁的质量分数: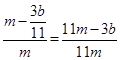


科目:高中化学 来源:不详 题型:实验题
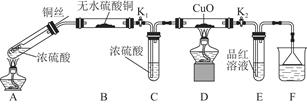
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
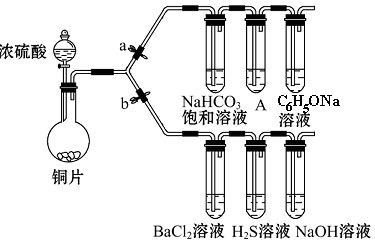
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两者都易溶于水 | B.两者都污染环境,危害健康 |
| C.两者都能使品红溶液褪色 | D.两者都是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
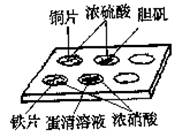
| A.①④ | B.②③ | C.①⑤ | D.②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
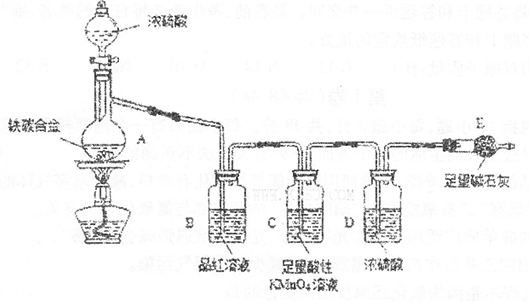
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
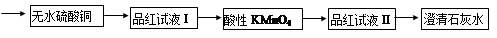
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
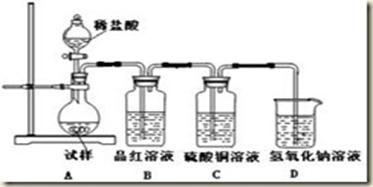
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com