
”¾ĢāÄæ”æ¢ń.ĻÖÓŠĻĀĮŠ°ĖÖÖĪļÖŹ£ŗ¢ŁŹ³ŃĪ¾§Ģ壻¢ŚŅŅ“¼£»¢Ū±ł“×Ėį£Ø“æ“×Ėį¾§Ģ壩£»¢ÜNaHSO4£»¢ŻKNO3ČÜŅŗ£»¢ŽČŪČŚµÄĒāŃõ»ÆÄĘ£»¢ßŅŗĢ¬ĀČ»ÆĒā£»¢ąCl2”£
£Ø1£©ĢīæÕ»Ų“š£ØĢīŠņŗÅ£©£ŗ
a”¢ŅŌÉĻĪļÖŹŹōÓŚ·Ēµē½āÖŹµÄŹĒ______”£
b”¢ŅŌÉĻĪļÖŹæÉŅŌµ¼µēµÄŹĒ________”£
£Ø2£©Š“³ö¢ÜČÜÓŚĖ®Ź±µÄµēĄė·½³ĢŹ½________”£
¢ņ.°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©µČÖŹĮæµÄCO2ŗĶCO£ŗĖłŗ¬ĘųĢåµÄ·Ö×ÓŹżÖ®±ČĪŖ_____£»
£Ø2£©ŹµŃéŹŅĄļŹ¢·ÅĒāŃõ»ÆÄĘČÜŅŗµÄŹŌ¼ĮĘæĘæČū²»ÄÜÓĆ²£Į§Čū£¬ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾ĘäÖŠµÄŌŅņ_____£»
£Ø3£©ĪŅ¹śÕžø®ĪŖĮĖĻū³żµāȱ·¦²”£¬¹ę¶ØŌŚŹ³ŃĪÖŠ±ŲŠė¼ÓČĖŹŹĮæµÄµāĖį¼Ų”£¼ģŃéŹ³ŃĪÖŠŹĒ·ń¼Óµā£¬æÉĄūÓĆČēĻĀ·“Ó¦£ŗKIO3 +KI+H2SO4 = K2SO4+ I2+H2O”£
¢Ł½«ÉĻĆęŃõ»Æ»¹Ō·“Ó¦µÄ»Æѧ·½³ĢŹ½ÅäĘ½___”£
¢ŚČē¹ū·“Ó¦ÖŠ×ŖŅĘ0.5molµē×Ó£¬ŌņÉś³ÉI2µÄĪļÖŹµÄĮæĪŖ_______mol”£
”¾“š°ø”æ¢Ś ¢Ż¢Ž NaHSO4=Na++H++SO42- 7:11 SiO2+2OH-=SiO32-+H2O 1”¢5”¢3”¢3”¢3”¢3 0.3mol
”¾½āĪö”æ
¢ń¢ŁŹ³ŃĪ¾§ĢåŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ŚŅŅ“¼ŹōÓŚ·Ēµē½āÖŹ£¬²»Äܵ¼µē£»¢Ū±ł“×Ėį£Ø“æ“×Ėį¾§Ģ壩ŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ÜNaHSO4ŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ŻKNO3ČÜŅŗŹōÓŚµē½āÖŹČÜŅŗ£¬Äܵ¼µē£»¢ŽČŪČŚµÄĒāŃõ»ÆÄĘŹōÓŚµē½āÖŹ£¬Äܵ¼µē£»¢ßŅŗĢ¬ĀČ»ÆĒāŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ąCl2²»ŹĒµē½āÖŹŅ²²»ŹĒ·Ēµē½āÖŹ£¬²»Äܵ¼µē£»µĆ³ö½įĀŪ”£
¢Ę¢ÜČÜÓŚĖ®Ź±µÄµēĄė·½³ĢŹ½£ŗNaHSO4 = Na++H++SO42£”£
¢ņ¢ÅµČÖŹĮæµÄCO2ŗĶCO£ŗ·Ö×ÓŹżÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£¬![]() £¬ÖŹĮæĻąµČ£¬ĪļÖŹµÄĮæÓėĦ¶ūÖŹĮæ³Ź·“±Č£¬
£¬ÖŹĮæĻąµČ£¬ĪļÖŹµÄĮæÓėĦ¶ūÖŹĮæ³Ź·“±Č£¬![]() £¬Ņņ“ĖĖłŗ¬ĘųĢåµÄ·Ö×ÓŹżÖ®±ČĪŖ7:11”£
£¬Ņņ“ĖĖłŗ¬ĘųĢåµÄ·Ö×ÓŹżÖ®±ČĪŖ7:11”£
¢ĘŹµŃéŹŅĄļŹ¢·ÅĒāŃõ»ÆÄĘČÜŅŗµÄŹŌ¼ĮĘæĘæČū²»ÄÜÓĆ²£Į§Čū£¬ĒāŃõøłŗĶ¶žŃõ»Æ¹č·“Ӧɜ³É¹čĖįøłŗĶĖ®”£
¢Ē¢ŁKIO3ÖŠµā»ÆŗĻ¼Ū½µµĶ5¼Ū£¬KIÖŠµā»ÆŗĻ¼ŪÉżøß1¼Ū£¬øł¾ŻÉż½µŹŲŗć½ųŠŠÅäĘ½£¬KIO3 +5KI+3H2SO4 =3 K2SO4+3I2+3H2O”£
¢Ś·“Ó¦·½³ĢŹ½×ŖŅĘ5molµē×Ó£¬Éś³É3molµ„ÖŹµā£¬Ņņ“Ė·“Ó¦ÖŠ×ŖŅĘ0.5molµē×Ó£¬ŌņÉś³ÉI2µÄĪļÖŹµÄĮæĪŖ0.3mol”£
¢ń¢ŁŹ³ŃĪ¾§ĢåŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ŚŅŅ“¼ŹōÓŚ·Ēµē½āÖŹ£¬²»Äܵ¼µē£»¢Ū±ł“×Ėį£Ø“æ“×Ėį¾§Ģ壩ŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ÜNaHSO4ŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ŻKNO3ČÜŅŗŹōÓŚµē½āÖŹČÜŅŗ£¬Äܵ¼µē£»¢ŽČŪČŚµÄĒāŃõ»ÆÄĘŹōÓŚµē½āÖŹ£¬Äܵ¼µē£»¢ßŅŗĢ¬ĀČ»ÆĒāŹōÓŚµē½āÖŹ£¬²»Äܵ¼µē£»¢ąCl2²»ŹĒµē½āÖŹŅ²²»ŹĒ·Ēµē½āÖŹ£¬²»Äܵ¼µē”£
¢Åa”¢ŅŌÉĻĪļÖŹŹōÓŚ·Ēµē½āÖŹµÄŹĒ¢Ś£»b”¢ŅŌÉĻĪļÖŹæÉŅŌµ¼µēµÄŹĒ¢Ż¢Ž£»¹Ź“š°øĪŖ£ŗ¢Ś£»¢Ż¢Ž”£
¢Ę¢ÜČÜÓŚĖ®Ź±µÄµēĄė·½³ĢŹ½£ŗNaHSO4 = Na++H++SO42££¬¹Ź“š°øĪŖ£ŗNaHSO4 = Na++H++SO42£”£
¢ņ¢ÅµČÖŹĮæµÄCO2ŗĶCO£ŗ·Ö×ÓŹżÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£¬![]() £¬ÖŹĮæĻąµČ£¬ĪļÖŹµÄĮæÓėĦ¶ūÖŹĮæ³Ź·“±Č£¬
£¬ÖŹĮæĻąµČ£¬ĪļÖŹµÄĮæÓėĦ¶ūÖŹĮæ³Ź·“±Č£¬![]() £¬Ņņ“ĖĖłŗ¬ĘųĢåµÄ·Ö×ÓŹżÖ®±ČĪŖ7:11£¬¹Ź“š°øĪŖ£ŗ7:11”£
£¬Ņņ“ĖĖłŗ¬ĘųĢåµÄ·Ö×ÓŹżÖ®±ČĪŖ7:11£¬¹Ź“š°øĪŖ£ŗ7:11”£
¢ĘŹµŃéŹŅĄļŹ¢·ÅĒāŃõ»ÆÄĘČÜŅŗµÄŹŌ¼ĮĘæĘæČū²»ÄÜÓĆ²£Į§Čū£¬ĒāŃõøłŗĶ¶žŃõ»Æ¹č·“Ӧɜ³É¹čĖįøłŗĶĖ®£¬Ąė×Ó·½³ĢŹ½±ķŹ¾ĘäÖŠµÄŌŅņSiO2+2OH-=SiO32£+H2O£¬¹Ź“š°øĪŖ£ŗSiO2+2OH-=SiO32£+H2O”£
¢Ē¢ŁKIO3ÖŠµā»ÆŗĻ¼Ū½µµĶ5¼Ū£¬KIÖŠµā»ÆŗĻ¼ŪÉżøß1¼Ū£¬øł¾ŻÉż½µŹŲŗć½ųŠŠÅäĘ½£¬KIO3 +5KI+3H2SO4 =3 K2SO4+3I2+3H2O£¬¹Ź“š°øĪŖ£ŗ1£»5£»3£»3£»3£»3”£
¢Ś·“Ó¦·½³ĢŹ½×ŖŅĘ5molµē×Ó£¬Éś³É3molµ„ÖŹµā£¬Ņņ“Ė·“Ó¦ÖŠ×ŖŅĘ0.5molµē×Ó£¬ŌņÉś³ÉI2µÄĪļÖŹµÄĮæĪŖ0.3mol£¬¹Ź“š°øĪŖ£ŗ0.3”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉč¼ĘČēĻĀŹµŃéĢ½¾æijæóŹÆ£Ø½öŗ¬ĖÄÖÖ¶ĢÖÜĘŚŌŖĖŲ£©µÄ×é³ÉŗĶŠŌÖŹ£¬ŅŃÖŖæóŹÆŗ¬ÓŠŅ»¶ØµÄ½į¾§Ė®£ŗ
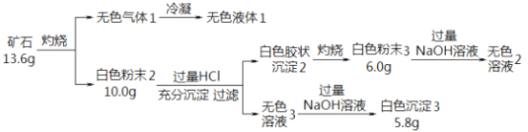
£Ø1£©æóŹÆµÄ×é³ÉŌŖĖŲŹĒ H”¢O ŗĶ_____”¢ ______£ØĢīŌŖĖŲ·ūŗÅ£©£¬»ÆѧŹ½ĪŖ_____________”£
£Ø2£©°×É«·ŪÄ©3 ČÜÓŚNaOHČÜŅŗµÄĄė×Ó·½³ĢŹ½ŹĒ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆ¾ŗĶĀĮ·Ö±šÓėµČÅØ¶Č”¢µČĢå»żµÄ¹żĮæĻ”ĮņĖį·“Ó¦£¬²śÉśĘųĢåµÄĢå»ż(V)ÓėŹ±¼ä(t)µÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£·“Ó¦ÖŠĆ¾ŗĶĀĮµÄ(””””)

A. ĪļÖŹµÄĮæÖ®±ČĪŖ3”Ć2 B. ÖŹĮæÖ®±ČĪŖ3”Ć2
C. Ħ¶ūÖŹĮæÖ®±ČĪŖ2”Ć3 D. Ź§Č„µÄµē×ÓŹżÖ®±ČĪŖ8”Ć9
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠ”×éÄ£ÄāŹŖ·Ø¼¼Źõ½«·ŪĖéµÄÓ”Ė¢µēĀ·°å¾Čܽā”¢ŻĶČ””¢µē½āµČ²Ł×÷»ŲŹÕĶŗĶÖĘČ”µØ·Æ£¬Į÷³Ģ¼ņĶ¼ČēĻĀ£ŗ

ŅŃÖŖĶ°±ČÜŅŗÖŠĶŌŖĖŲŅŌ[Cu(NH3)4]2+ŠĪŹ½“ęŌŚ”£
ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A.·“Ó¦¢ńÖŠH2O2µÄ×÷ÓĆŹĒ»¹Ō¼Į£¬²Ł×÷¢ŁµÄĆū³ĘŹĒ¹żĀĖ
B.²Ł×÷¢ŚŗĶ¢ŪÓƵ½µÄÖ÷ŅŖŅĒĘ÷¶¼ŹĒ·ÖŅŗĀ©¶·£¬ĘäÖŠ²Ł×÷¢ŚµÄÄæµÄŹĒŌö¼Ó![]() ŌŚĖ®ÖŠµÄČܽā¶Č
ŌŚĖ®ÖŠµÄČܽā¶Č
C.²Ł×÷¢ÜŹĒ¼ÓČė¹żĮæµÄĢś·Ū£¬¹żĀĖ£»²Ł×÷¢ŻµÄÖ÷ŅŖ²½ÖčŹĒÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ
D.Į÷³ĢÖŠæÉŃ»·Ź¹ÓƵďŌ¼ĮÓŠNH4Cl”¢ÓŠ»śČܼĮŗĶĮņĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éÓū“Óŗ¬ÓŠĢśµÄŃõ»ÆĪļ¼°ÉŁĮæFeS”¢SiO2µÄÉÕŌüÖŠ·ÖĄė³ö¶žŃõ»Æ¹č²¢ÖʱøĀĢ·Æ£ØFeSO4”¤7H2O£©¹ĢĢ壬ŹµŃé¹ż³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗŅ»¶ØĢõ¼žĻĀ¹ĢĢåĮņæÉČÜÓŚĒāŃõ»ÆÄĘČÜŅŗ”£Ēė»Ų“š£ŗ
£Ø1£©²½Öč¢ŁÖŠ£¬ŹŌ¼ĮXÓ¦²ÉÓĆ________”£
£Ø2£©ÖʱøĀĢ·ÆŹ±£¬ĻņČÜŅŗ1ÖŠ¼ÓČė¹żĮæŹŌ¼ĮY£¬³ä·Ö·“Ó¦ŗ󣬾________²Ł×÷µĆµ½ČÜŅŗ2”£
£Ø3£©Éč¼Ę¼ņµ„ŹµŃé·½°øŃéÖ¤²½Öč¢ŚµĆµ½µÄSiO2¹ĢĢåÖŠ²»ŗ¬S________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŅ¹śæĘѧ¼Ņ×ī½ü³É¹¦ŗĻ³ÉĮĖŹĄ½ēÉĻŹ×øöĪåµŖŅõĄė×ÓŃĪ(N5)6(H3O)3(NH4)4Cl£ØÓĆR“ś±ķ£©”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µŖŌ×Ó¼Ū²ćµē×ӵĹģµĄ±ķ“ļŹ½£Øµē×ÓÅŲ¼Ķ¼£©ĪŖ___”£
£Ø2£©ŌŖĖŲµÄ»łĢ¬ĘųĢ¬Ō×ӵƵ½Ņ»øöµē×ÓŠĪ³ÉĘųĢ¬øŗŅ»¼ŪĄė×ÓŹ±Ėł·Å³öµÄÄÜĮæ³Ę×÷µŚŅ»µē×ÓĒ×ŗĶÄÜ£ØE1£©”£µŚ¶žÖÜĘŚ²æ·ÖŌŖĖŲµÄE1±ä»ÆĒ÷ŹĘČēĶ¼£Øa£©ĖłŹ¾£¬ĘäÖŠ³żµŖŌŖĖŲĶā£¬ĘäĖūŌŖĖŲµÄE1×Ō×ó¶ųÓŅŅĄ“ĪŌö“óµÄŌŅņŹĒ___£»µŖŌŖĖŲµÄE1³ŹĻÖŅģ³£µÄŌŅņŹĒ___”£
£Ø3£©¾XÉäĻßŃÜÉä²āµĆ»ÆŗĻĪļRµÄ¾§Ģå½į¹¹£¬Ęä¾Ö²æ½į¹¹ČēĶ¼£Øb£©ĖłŹ¾”£
¢Ł“Ó½į¹¹½Ē¶Č·ÖĪö£¬RÖŠĮ½ÖÖŃōĄė×ÓµÄĻąĶ¬Ö®“¦ĪŖ___£¬²»Ķ¬Ö®“¦ĪŖ____”££ØĢī±źŗÅ£©
A£®ÖŠŠÄŌ×ÓµÄŌӻƹģµĄĄąŠĶ B£®ÖŠŠÄŌ×ӵļŪ²ćµē×Ó¶ŌŹż
C£®Į¢Ģå½į¹¹ D£®¹²¼Ū¼üĄąŠĶ
¢ŚĶ¼£Øb£©ÖŠŠéĻß“ś±ķĒā¼ü£¬Ęä±ķŹ¾Ź½ĪŖ£ØNH4+£©N-H©ØCl”¢____”¢____”£

£Ø4£©RµÄ¾§ĢåĆܶČĪŖd g”¤cm-3£¬ĘäĮ¢·½¾§°ū²ĪŹżĪŖanm£¬¾§°ūÖŠŗ¬ÓŠyøö[(N5)6(H3O)3(NH4)4Cl]µ„ŌŖ£¬øƵ„ŌŖµÄĻą¶ŌÖŹĮæĪŖM£¬ŌņyµÄ¼ĘĖć±ķ“ļŹ½ĪŖ____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬ĻĀĮŠÓŠ¹ŲČÜŅŗÖŠĪ¢Į£µÄĪļÖŹµÄĮæÅØ¶Č¹ŲĻµ²»ÕżČ·µÄŹĒ£Ø £©
A.0.1mol”¤L£1 CH3COONaČÜŅŗÓė0.1mol”¤L£1 HClČÜŅŗµČĢå»ż»ģŗĻ£ŗc(Na+)=c(Cl£)>c(H+)>c(CH3COO£)
B.0.1mol”¤L£1NH4ClČÜŅŗÓė0.1mol”¤L£1°±Ė®µČĢå»ż»ģŗĻ£ØpH>7£©£ŗc(NH4+)>c(Cl£)>c(NH3”¤H2O)>c(OH£) >c(H+)
C.0.1mol”¤L£1Na2CO3ČÜŅŗÓė0.1mol”¤L£1NaHCO3ČÜŅŗµČĢå»ż»ģŗĻ£ŗ2c(Na+)=3[c(CO32£)£«c(HCO3£)£«c(H2CO3)]
D.0.1mol”¤L£1Na2C2O4ČÜŅŗÓė0.1mol”¤L£1 HClČÜŅŗµČĢå»ż»ģŗĻ£ØH2C2O4ĪŖ¶žŌŖČõĖį£©£ŗ2c(C2O42£)£«c(HC2O4£)£«c(OH£)=c(Na+)£«c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļAŹĒŗĻ³ÉĢģČ»Ļš½ŗµÄµ„Ģ壬·Ö×ÓŹ½ĪŖC5H8£¬AµÄŅ»ĻµĮŠ·“Ó¦ČēĻĀ(²æ·Ö·“Ó¦Ģõ¼žĀŌČ„)£ŗ

ŅŃÖŖ£ŗ
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)AµÄ½į¹¹¼ņŹ½ĪŖ_____________£¬»ÆѧĆū³ĘŹĒ________________________”£
(2)BµÄ·Ö×ÓŹ½ĪŖ__________________________”£
(3)¢Ś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________________”£
(4)¢ŁŗĶ¢ŪµÄ·“Ó¦ĄąŠĶ·Ö±šŹĒ___________”¢______________”£
(5)CĪŖµ„äå“śĪļ£¬·Ö×ÓÖŠÓŠĮ½øöŃĒ¼×»ł£¬¢ÜµÄ»Æѧ·½³ĢŹ½ŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧÓĆÓļ±ķ“ļÕżČ·µÄŹĒ£Ø£©
A.Ć÷·Æ¾»Ė®£ŗAl3++3H2O![]() Al(OH)3”ż+3H+
Al(OH)3”ż+3H+
B.ĀČ»Æļ§ČÜÓŚĖ®£ŗNH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.ŃĒĮņĖįČÜŅŗÖŠ£ŗH2SO3![]() 2H++SO32-
2H++SO32-
D.ŌŚŠ”ĖÕ“ņČÜŅŗÖŠµĪ¼ÓĒāŃõ»ÆÄĘ£ŗHCO3©+OH©=CO2”ü+H2O
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com