
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.原子半径的大小顺序: Y<Z<W<X |
| B.化合物YX、ZX2、WX3中化学键的类型相同 |
| C.非金属性的强弱顺序:X>W>Z |
| D.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
C
解析试题分析:X原子的最外层电子数是其内层电子总数的3倍,则该元素只能是第二周期元素,是氧元素。W与X属于同一主族,因此W是S元素。Y原子的最外层只有2个电子,Z单质可制成半导体材料,且二者的原子序数均小于S的,而大于氧元素的,所以Y是Mg,Z是Si。同周期自左向右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,则四种元素的原子半径的大小顺序是Y>Z>W>X,选项A不正确;化合物MgO、SiO2、SO3中的化学键分别是离子键、共价键和共价键,选项B不正确;同周期自左向右非金属性逐渐减弱,同主族自上而下,非金属性逐渐增强,所以选项C正确;非金属性越强,最高价氧化物的水化物的酸性越强,所以硫酸的酸性强于硅酸的,D不正确,答案选C。
考点:考查元素周期表第结构和元素周期律的应用
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:单选题
铀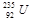 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀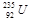 的说法正确的是
的说法正确的是
A.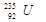 与 与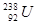 的性质完全相同 的性质完全相同 |
B.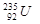 原子核中含有143个中子 原子核中含有143个中子 |
C.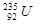 属于短周期元素 属于短周期元素 |
D.1mol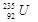 的质量是143g 的质量是143g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铋(Bi)在医药方面有重要应用。 下列关于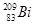 和
和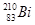 的说法正确的是
的说法正确的是
A.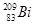 和 和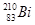 都含有83个中子 都含有83个中子 |
B.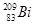 和 和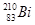 互为同位素 互为同位素 |
C.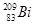 和 和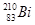 的核外电子数不同 的核外电子数不同 |
D.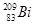 和 和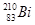 分别含有126和127个质子 分别含有126和127个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是 ( )
| A.X能形成化学式为NaXO3的含氧酸钠盐 |
| B.X元素气态氢化物的水溶液呈酸性 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
超铀元素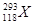 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子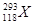 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Y原子中电子运动状态有 种, Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,其基态原子简化电子排布式为 。交警可以用H2SO4酸化的K2 Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。
请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式
。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸。请根据以上信息回答下列问题。
(1)F元素在元素周期表中的位置是______________。
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因:______________。
(3)A2C2可以制备C2,该反应的化学方程式是______________。
(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是___________。
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B ,C_______,D 。
(2)D的质子数和中子数相等,D的原子组成符号为 ,它的最高价为___________价。
(3)用电子式表示A、D两元素形成AD2的过程: ;
写出C2B2的电子式 。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
。
(5)写出甲和A的最高价氧化物反应的化学方式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com