
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.③④ | C.③⑥ | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NaOH溶液至沉淀质量不再变化,用去350mLNaOH溶液。则所取样品中铝的物质的量为( )
NaOH溶液至沉淀质量不再变化,用去350mLNaOH溶液。则所取样品中铝的物质的量为( )查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是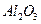 ,含
,含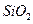 、
、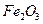 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: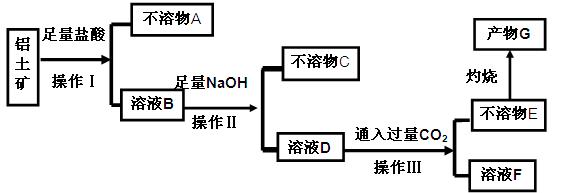

 请回答下列问题:
请回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
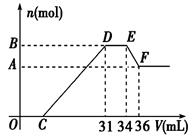
 程式:
程式:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
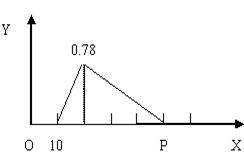
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.9g | B.4.6g | C.5.5g | D.6.9g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com