
【题目】在溶液中,反应A+2B![]() C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol·L-1、c(B)=0.200mol·L-1及c(C)=0mol·L-1,反应物A的浓度随时间的变化如图所示。下列说法不正确的是
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol·L-1、c(B)=0.200mol·L-1及c(C)=0mol·L-1,反应物A的浓度随时间的变化如图所示。下列说法不正确的是
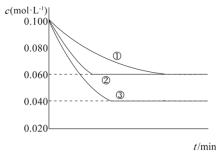
A.与①比较,②可能加入催化剂
B.与①比较,③可能是增大了压强
C.实验②平衡时B的转化率为40%
D.该反应的ΔH﹥0
【答案】D
【解析】
题中提供的是A浓度随时间变化的图像,根据反应速率的表达式,图像中浓度变化越快表明反应速率越大;最终平衡时,若两个体系的A的浓度相等,则表明两个体系平衡组成相同;A的平衡浓度越小,表明反应整体向右进行的更彻底。
A.由图可知,②相比于①反应速率更大,但平衡时组成都相同;加入催化剂能够提高反应速率,但不会影响平衡,A项正确;
B.由图可知,③相比于①,反应速率更快,并且反应向右进行的更彻底;加压可以提高反应速率,也可以让平衡正向移动,反应进行更彻底,B项正确;
C.由图可知,②达到平衡时,A的浓度下降了0.04mol/L,那么B的浓度就下降0.08mol/L,由转化率的定义计算可知,B的转化率为40%,C项正确;
D.由题干的信息无法判断反应是吸热还是放热的,D项错误;
答案选D。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法![]() 的名称为2-甲基-3,5-二乙基己烷
的名称为2-甲基-3,5-二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质
C.等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加
D.下列物质的沸点按由低到高顺序为:(CH3CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3<(CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO的制备原理:HCOOH![]() CO↑+H2O.(常温下甲酸为液体)
CO↑+H2O.(常温下甲酸为液体)
(1)原料气CH3CH=CH2、CO和H2的制备均可用图1装置:
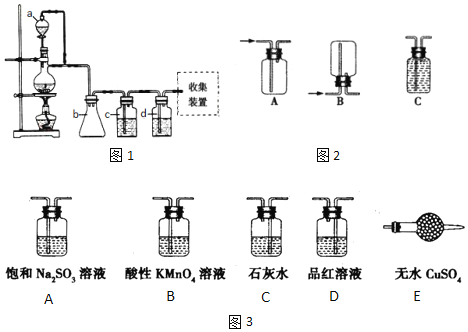
填写下列空白:
①若用上述装置制备氢气,收集装置可选用图2下列______装置
②若用上述装置制备干燥纯净的CO气体,装置b的作用是______;c中盛装的试剂是______。
为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是______。
③实验室用浓硫酸和2-丙醇制备丙烯时,还产生少量SO2、CO2及水蒸气,该小组用图3试剂检验这四种气体,混合气体通过试剂的顺序是______(填序号,试剂可以重复使用);写出2-丙醇与浓硫酸反应生成SO2、CO2及水蒸气的化学方程式______;
(2)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______。
a.低温、高压、催化剂b.适当的温度、高压、催化剂
c.常温、常压、催化剂d.适当的温度、常压、催化剂
(3)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如图提纯路线:
![]()
试剂1为______,操作3为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是( )
A.将40g NaOH溶解在1L水中
B.将22.4L HCl气体溶于水配成1L溶液
C.将1L 10 mol/L浓盐酸加入9L水中
D.将10g NaOH溶于少量水,在稀释到溶液为250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:

下列说法错误的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
C. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
D. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com