
已知:
①I2(g)+H2(g) 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.I2(g)=I2(s) ΔH=-17.00 kJ/mol
C.固态碘的稳定性比气态碘的稳定性高
D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2,下列有关说法正确的是( )
Li2O2,下列有关说法正确的是( )
A.充电时,多孔金制成的电极外接电源负极
B.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
C.放电时,Li+从负极向正极移动
D.该电池可使用含Li+的水溶液作电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
氨的催化氧化过程主要有以下两个反应:
(ⅰ)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
(ⅱ)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
测得温度对NO、N2产率的影响如图所示。下列说法错误的是( )
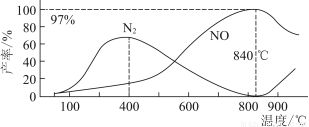
A.升高温度,反应(ⅰ)和(ⅱ)的平衡常数均减小
B.840 ℃后升高温度,反应(ⅰ)的正反应速率减小,反应(ⅱ)的正反应速率增大
C.900 ℃后,NO产率下降的主要原因是反应(ⅰ)平衡逆向移动
D.800 ℃左右时,氨的催化氧化主要按照(ⅰ)进行
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是( )
A.Y、Z、R 3种元素组成的化合物水溶液一定显碱性
B.原子半径:Z>R>W
C.气态氢化物稳定性:HW>H2R
D.XW4分子中各原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:填空题
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4 (g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:选择题
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-a kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-b kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-c kJ·mol-1(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是( )
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是( )
A.硫化钠的水解反应:S2-+2H2O H2S+2OH-
H2S+2OH-
B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3—+OH-=CO32—+H2O
D.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:选择题
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病。其转化过程如下:
OHCH2CH—COOHNH2―→OHCH2COCOOH  HOCH2COOHOH
HOCH2COOHOH
酪氨酸 对羟苯丙酮酸 尿黑酸
下列说法错误的是( )
A.1 mol酪氨酸能与含1 mol HCl的盐酸反应,又能与含2 mol NaOH的溶液反应
B.酪氨酸能发生加成、取代、消去和缩聚反应
C.1 mol对羟苯丙酮酸最多可与4 mol H2反应
D.1 mol尿黑酸最多可与含3 mol Br2的溶液反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题13化学实验基础练习卷(解析版) 题型:选择题
下列对Ⅰ~Ⅳ实验的现象预测正确的是( )
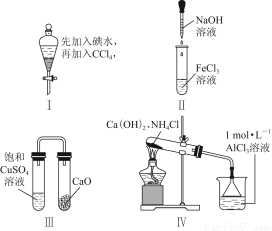
A.实验Ⅰ:振荡后静置,液体分层,下层液体无色
B.实验Ⅱ:滴入氢氧化钠溶液后,试管中出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色
C.实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体
D.实验Ⅳ:加热后,水槽中先生成白色沉淀,后逐渐溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com