
【题目】已知![]() 的
的![]() 溶液中
溶液中![]() 的浓度为
的浓度为![]() ,请回答下列问题:
,请回答下列问题:
(1)下列物质能导电的是__________,属于电解质的是__________,属于非电解质的是__________,(填序号)
①氯化钠晶体 ②氨气 ③水银 ④蔗糖 ⑤石墨 ⑥熔融![]() ⑦空气 ⑧BaSO4 ⑨稀盐酸
⑦空气 ⑧BaSO4 ⑨稀盐酸
(2)写出![]() 在水溶解中的电离方程式:_________________;写出NaHSO4在熔融状态下的电离方程式:_______________________________。
在水溶解中的电离方程式:_________________;写出NaHSO4在熔融状态下的电离方程式:_______________________________。
(3)![]() 溶液与NaHCO3溶液混合有气泡生成,反应的离子方程式_______________
溶液与NaHCO3溶液混合有气泡生成,反应的离子方程式_______________
(4)①若![]() 与
与![]() 溶液混合后溶液显中性,请写出反应的离子方程式_________________________________________________________________。
溶液混合后溶液显中性,请写出反应的离子方程式_________________________________________________________________。
②若![]() 与
与![]() 溶液中混合溶液呈碱性,请写出反应的离子方程式___________________________________________________。
溶液中混合溶液呈碱性,请写出反应的离子方程式___________________________________________________。
【答案】 ③⑤⑥⑨ ①⑥⑧ ②④ NaHSO4=Na++H++SO42- NaHSO4=Na++HSO4- H++HCO3-=H2O+CO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+H2O Ba2++OH-+H++SO42-=BaSO4↓+H2O
【解析】(1)水银、石墨中存在自由移动的电子,能导电;熔融![]() 和稀盐酸中存在自由移动的离子,能导电,答案选③⑤⑥⑨;氯化钠晶体、熔融
和稀盐酸中存在自由移动的离子,能导电,答案选③⑤⑥⑨;氯化钠晶体、熔融![]() 、BaSO4 是在水溶液中或熔融状态下能导电的化合物,则①⑥⑧属于电解质;氨气在水电离的不是其本身,则氨气属于非电解质;蔗糖是在水溶液中和熔融状态下都不能导电的化合物,属于非电解质;故②④属于非电解质;(2)NaHSO4在水溶液中电离出钠离子、氢离子、硫酸根,电离方程式为NaHSO4=Na++H++SO42-;在熔融状态下电离出钠离子和硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-;(3)
、BaSO4 是在水溶液中或熔融状态下能导电的化合物,则①⑥⑧属于电解质;氨气在水电离的不是其本身,则氨气属于非电解质;蔗糖是在水溶液中和熔融状态下都不能导电的化合物,属于非电解质;故②④属于非电解质;(2)NaHSO4在水溶液中电离出钠离子、氢离子、硫酸根,电离方程式为NaHSO4=Na++H++SO42-;在熔融状态下电离出钠离子和硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-;(3)![]() 溶液与NaHCO3溶液混合氢离子与碳酸氢根离子反应,有气泡生成,反应的离子方程式为:H++HCO3-=H2O+CO2↑;(4)①若
溶液与NaHCO3溶液混合氢离子与碳酸氢根离子反应,有气泡生成,反应的离子方程式为:H++HCO3-=H2O+CO2↑;(4)①若![]() 与
与![]() 溶液混合后溶液显中性,反应完全中和,离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O;②若
溶液混合后溶液显中性,反应完全中和,离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O;②若![]() 与
与![]() 溶液中混合溶液呈碱性,则可能沉淀完全而氢氧化钡过量,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O。
溶液中混合溶液呈碱性,则可能沉淀完全而氢氧化钡过量,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. NA个氧气分子与NA个氖气分子的质量比是4∶5
B. 17gOH-与19gH3O+所含质子数相等
C. 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等
D. 12g C和16g O所含的原子数不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法正确的是( )
A.矿泉水中不含任何化学物质B.聚乙烯塑料薄膜可用作食品包装袋
C.碳酸钡可用作医疗上的“钡餐”D.氢氧化钠可用作治疗胃酸过多的药物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某化学反应中,气体混合物A、B、C的物质的量浓度(mol L1)与时间t(s)的关系如下表所示。
t/s | 200 | 400 | 800 |
c(A)/(mol L1) | 1.45 | 1.28 | 1.00 |
c(B)/(mol L1) | 0.38 | 0.72 | 1.28 |
c(C)/(mol L1) | 0.095 | 0.18 | 0.32 |
(1)该反应的化学方程式为___________________。
(2)用A的浓度变化表示200~800 s内反应的平均反应速率为__________mol L1 min1。
(3)用C的浓度变化表示400800 s内反应的平均反应速率为__________mol L1 s1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:
A2(g)+3B(g) ![]() 2C2 (g)+2D(g),以下表示反应达到平衡是( )
2C2 (g)+2D(g),以下表示反应达到平衡是( )
A. v正(B)=0.03 mol/(Ls),v逆(D)=1.2 mol/(Lmin)
B. 容器中气体的平均相对分子质量不随时间变化而变化
C. 容器中总压强不随时间变化而变化
D. 单位时间内断裂一个A-A键,同时生成两个C-C键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展了一系列的化学实验活动。

请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录 得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于 、 仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器是 ;
③仪器甲、乙接口的连接方式如下:A连接 ,B连接 ,C连接 (填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是 。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与稀盐酸反应的反应速率,某同学通过实验测定了反应过程中生成的CO2气体的体积随反应时间的变化情况,绘制出如图所示曲线。请回答下列问题:
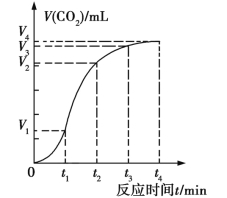
(1)碳酸钙与稀盐酸的反应是放热反应,这是由于反应物的总能量 (填“大于”或“小于”)生成物的总能量。
(2)在0~t1、t1~t2、t2~t3、t3~t4各相等的时间段内, 收集到气体最多的是 时间段,反应速率最大的是 时间段,反应速率最小的是 时间段。
(3)t1~t2时间段内影响反应速率的主要外界因素是 (填“温度”、“浓度”、“压强”或“催化剂”,下同),t2~t3时间段内影响反应速率的主要外界因素是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择不合理的是
A. 可用蒸发结晶的方法从碘水中提取砷单质
B. 可用灼烧法除去氧化制中混有的铜粉
C. 可用硫酸鉴别碳酸钠、硅酸钠和硫酸钠
D. 可用含氢氧化钠的氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列晶体熔化:氢氧化钠、四氯化碳、二氧化硅、氧化钙,需要克服的微粒间的相互作用力依次是①共价键 ②离子键 ③分子间作用力,正确的顺序是( )
A.①②②③B.②①③②C.②③①②D.①①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com