
| 主族 周期 | ⅠA | ⅡA | ⅢA | A | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
| ||
| 冰晶石 |
| ||
| 冰晶石 |
 ,故答案为:离子键、共价键;
,故答案为:离子键、共价键; .
.


科目:高中化学 来源: 题型:
| A、1mol Na2O和Na2O2的混合物中所含阴离子数为NA |
| B、1.7g H2O2中含有的电子数为0.9NA |
| C、1mol Na2O2与足量的CO2反应,电子转移数为2NA |
| D、标准状况下,2.24L CO2和CO中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

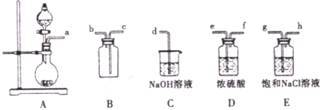
| 实验序号 | 实验操作 | 现象 |
| 甲 | 将氯水滴入品红溶液 | ① |
| 乙 | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | 0 | |||||||
| 一 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 二 | R | X | ||||||
| 三 | Y | Z | W | M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com