
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
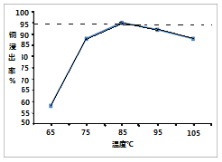
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。
(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。
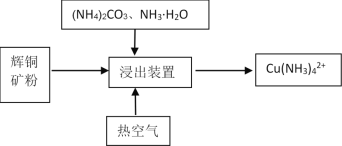
其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。
【答案】![]() H2O2把生成Fe2+又氧化为Fe3+,c(Fe3+)的浓度增大,反应速率加快 温度升高, H2O2发生了分解 4Fe2++O2+4H+=4Fe3++2H2O 由于浸取剂的pH = 1,加入适量的CuO,不引入其它杂质离子,消耗H+有利于控制溶液pH,使Fe3+形成Fe(OH)3沉淀 提高慢反应的速率,即提高Cu+的氧化速率 S2O82-的氧化性比O2强,使慢反应的速率加快,促使Cu2S沉淀溶解平衡正向移动,同时(NH4)2S2O8电离产生NH4+,NH4+与慢反应产生的OH-结合,c(OH-)的浓度降低,有利于慢反应及Cu2S沉淀溶解平衡正向移动
H2O2把生成Fe2+又氧化为Fe3+,c(Fe3+)的浓度增大,反应速率加快 温度升高, H2O2发生了分解 4Fe2++O2+4H+=4Fe3++2H2O 由于浸取剂的pH = 1,加入适量的CuO,不引入其它杂质离子,消耗H+有利于控制溶液pH,使Fe3+形成Fe(OH)3沉淀 提高慢反应的速率,即提高Cu+的氧化速率 S2O82-的氧化性比O2强,使慢反应的速率加快,促使Cu2S沉淀溶解平衡正向移动,同时(NH4)2S2O8电离产生NH4+,NH4+与慢反应产生的OH-结合,c(OH-)的浓度降低,有利于慢反应及Cu2S沉淀溶解平衡正向移动
【解析】
Ⅰ.(1)反应过程中有黄色固体生成,说明Cu2S与Fe2(SO4)3反应产生了硫单质,据此写离子方程式;
(2) H2O2具有氧化性;
(3)温度高,H2O2易分解;
(4) O2的可以将亚铁离子氧化;加入CuO的不引入其它杂质离子,消耗H+有利于控制溶液pH,使Fe3+形成Fe(OH)3沉淀;
Ⅱ.(5)根据反应机理,提高铜的浸出率的关键在慢反应;
(6)根据(NH4)2S2O8的性质分析作答。
Ⅰ.(1)反应过程中有黄色固体生成,说明Cu2S与Fe2(SO4)3反应产生了硫单质,则离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) 浸出过程中铁离子变为亚铁离子,H2O2具有氧化性,可以再使亚铁离子氧化为铁离子,加快反应速率,故答案为:H2O2把生成Fe2+又氧化为Fe3+,c(Fe3+)的浓度增大,反应速率加快;
(3)H2O2受热易分解,故答案为:温度升高, H2O2发生了分解;
(4) O2可以将亚铁离子氧化,离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;加入CuO的不引入其它杂质离子,消耗H+有利于控制溶液pH,使Fe3+形成Fe(OH)3沉淀,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;由于浸取剂的pH = 1,加入适量的CuO,不引入其它杂质离子,消耗H+有利于控制溶液pH,使Fe3+形成Fe(OH)3沉淀;
Ⅱ.(5)根据反应机理,反应有快慢之分,提高铜的浸出率的关键在慢反应,故答案为:提高慢反应的速率,即提高Cu+的氧化速率;
(6)(NH4)2S2O8电离为S2O82-和NH4+,S2O82-的氧化性比O2强,使慢反应的速率加快,促使Cu2S沉淀溶解平衡正向移动,同时(NH4)2S2O8电离产生NH4+,NH4+与慢反应产生的OH-结合,c(OH-)的浓度降低,有利于慢反应及Cu2S沉淀溶解平衡正向移动,故答案为:S2O82-的氧化性比O2强,使慢反应的速率加快,促使Cu2S沉淀溶解平衡正向移动,同时(NH4)2S2O8电离产生NH4+,NH4+与慢反应产生的OH-结合,c(OH-)的浓度降低,有利于慢反应及Cu2S沉淀溶解平衡正向移动。


科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙试剂显红色的溶液中:Na、Fe2、Cl-、NO3-
B.滴入KSCN显血红色的溶液中:NH4、Al3、NO3-、SO42-
C.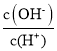 =1012的溶液中:NH4+、K+、Cl-、HCO3-
=1012的溶液中:NH4+、K+、Cl-、HCO3-
D.由水电离的c(H+)=1.0×l0-13mol/L溶液中:K、Al3、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
② ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。
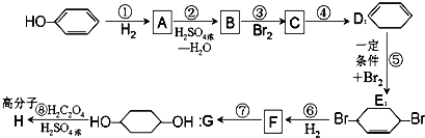
请回答下列问题:
(1)B,F的结构简式为:B___,F_______;
(2)反应①~⑦中属于消去反应的是(填代号)_______;
(3)根据反应![]() +Br2
+Br2![]()
![]() ,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__;
,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__;
(4)写出第④步C→![]() 的化学方程式(有机物写结构简式,注明反应条件)__;
的化学方程式(有机物写结构简式,注明反应条件)__;
(5)与4个不同的原子或原子团相连的碳原子称为手性碳原子;A﹣G这七种有机物分子中含有手性碳原子的是(填序号)__;
(6)核磁共振谱是测定有机物分子结构最有用的工具之一,在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目,例如:乙醛的结构式为:![]() ,其PMR谱中有2个信号峰,其强度之比为3:1,则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是__。
,其PMR谱中有2个信号峰,其强度之比为3:1,则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是__。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.漂白粉可以用于生活用水的消毒
B.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
C.氯气通入水中杀菌消毒,发生了化学变化
D.漂白粉在空气中久置变质,原因是原白粉中的CaCl2与空气中的CO2反应生成CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com