

| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应可以进行 | D. | 2C-+B2═2B-+C2反应不能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
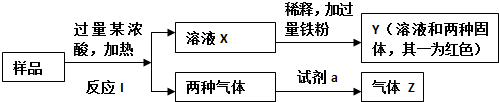
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
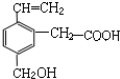
| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物[ | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |
| B. | 反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸 | |
| B. | 颗粒状锶单质与稀硫酸反应,反应现象不如钠与水反应剧烈 | |
| C. | 锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱 | |
| D. | 锶在纯净氮气中可以燃烧,燃烧产物与水反应可以放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作钡餐,Ba2+ 对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱的多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物鉴定,${\;}_{\;}^{12}$C与${\;}_{\;}^{12}$C互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com