
【题目】下列关于有机物的说法中,错误的是
A. 乙烯在常温常压下是气体,能使溴的四氯化碳溶液褪色
B. 苯可做有机溶剂,能使酸性高锰酸钾溶液褪色
C. 乙醇和乙烷都能发生取代反应
D. 乙酸乙酯在酸性条件下可以水解生成乙酸和乙醇
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25 g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
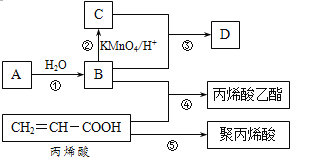
(1)A的电子式为___________,C中官能团的名称为__________。
(2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。
A.加成反应
B.取代反应
C.加聚反应
D.中和反应
E.氧化反应
(3)用两种方法鉴别B和C,所用试剂分别是___________、___________。
(4)丙烯酸乙酯的结构简式为 。
(5)写出下列反应方程式和有机反应基本类型:
①____________________ _ _______,_________反应;
④____________________ _ _______,_________反应;
⑤____________________ _ _______,_________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
弱酸 | 电离平衡常数(25 ℃) |
HClO | K=2.98×10-8 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,降低温度,K值________(填“变大”“变小”或“不变”)。
②下列离子方程式和有关说法错误的是____________。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2===2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-===2HCO3-+SO32-
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:___ 。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是_______。
Cr2O72- (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是_______。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
③CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子晶体中如果不是由于分子本身形状的影响,它的晶体将取密堆积结构,原因是分子晶体中( )
A.分子间作用力无一定方向性
B.占据晶格结点的微粒是原子
C.化学键是共价键
D.三者都是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备纳米颗粒Y(化合物)的反应为:
3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1 mol O2参加反应,转移的电子总数为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:________________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)D→A所加试剂及反应条件为____________________;反应类型为__________________;
(5)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有________(填字母)。
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是____________,原子利用率最高的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com