
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
| 编号 | 实验 | 现象 |
| a | 放入蒸馏水 | 木条燃烧 |
| b | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
分析 (1)①隔一段时间检测,发现pH逐渐减小,酸性增强,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;
②因为酸性物质能和很多物质反应,所以酸雨的危害是很多方面的,如:腐蚀建筑物,毁坏庄稼,使土壤酸化,使水体显酸性,以及树木枯萎等;
(2)①玻璃塞中含有二氧化硅,利用二氧化硅与碱反应来分析;
②Na2SiO3饱和溶液含有两种物质,要作对比实验;
(3)①空气中的氮气与氧气在放电的条件下生成一氧化氮;
②由N元素的化合价变化及氧化还原反应以及二氧化氮与N2O4的化学平衡来分析.
解答 解:(1)①隔一段时间检测,发现pH逐渐减小,酸性增强,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,故答案为:2H2SO3+O2═2H2SO4;
②因为酸性物质能和很多物质反应,所以酸雨的危害是很多方面的,如:腐蚀建筑物,毁坏庄稼,使土壤酸化,使水体显酸性,以及树木枯萎等.
故答案为:abd;
(2)①因玻璃塞中的二氧化硅与氢氧化钠反应生成硅酸钠,具有粘合性,使试剂瓶在下次使用时不能打开,其离子反应为SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
②Na2SiO3饱和溶液含有两种物质水和硅酸钠,要作对比实验来证明是硅酸钠起防火作用,而不是水,
故答案为:与实验b作对照,证明起防火作用的是Na2SiO3而不是水;
(3)①空气中的氮气与氧气在放电的条件下生成一氧化氮,反应方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
②由信息可知2NO→N2O,N的化合价降低2价,由氧化还原反应可知,则必有另一变化升高2价,依题意产物为NO2,该反应为3NO=N2O+NO2,此时压强降至原压强的$\frac{2}{3}$,如果压强降至略小于原压强的$\frac{2}{3}$,故答案为:3NO=N2O+NO2.
点评 本题主要考查环境方面的知识,解答时应该从造成环境污染的原因方面进行分析、判断,从而找出酸雨的危害,是对学生综合能力的考查,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 光导纤维是以二氧化硅为主要原料制成的 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 绿色食品是指不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | Li、Na、K、Rb熔沸点依次减弱 | |
| C. | 金刚石的硬度、熔点、沸点都高于晶体硅 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度为0.1 mol/L 的FeI2溶液中通入Cl2,Fe2+先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向等浓度的FeCl3溶液加入质量相等且颗粒大小相同的铁和铜,铜先反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇碘单质是否变蓝-淀粉和纤维素 | |
| B. | 遇浓硝酸是否变黄-某些蛋白质和油脂 | |
| C. | 与氯气混合后光照,气体颜色是否逐渐变浅-甲烷和乙烷 | |
| D. | 与新制的氢氧化铜共热是否产生砖红色沉淀-葡萄糖和蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
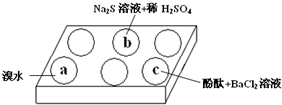 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
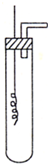 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com