
分析 无水氯化钙能够吸收水蒸气,气体质量减少25.2g为水蒸气质量,根据生成水的质量可以计算一氧化碳的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO、CO2的总的物质的量,设CO、CO2的物质的量分别为xmol、ymol,根据二者物质的量及质量列方程计算x、y的值,根据m=nM计算CO的质量.
解答 解:无水CaCl2时CaCl2增重25.2克,则水的质量为25.2g,所以n(H2O)=$\frac{25.2g}{18g/mol}$=1.4mol,
根据H原子守恒可计算CH4的物质的量为n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.4mol=0.7mol,
根据C原子守恒,可知CO和CO2的总的物质的量为0.7mol,
由于水的质量为25.2g,所以一氧化碳和二氧化碳的质量为:49.6g-25.2g=24.4g,
设CO、CO2的物质的量分别为xmol、ymol,则:x+y=0.7、28x+44y=22.4,
解得:x=0.4、y=0.3,
所以混合气中CO的质量为:0.4mol×28g/mol=11.2g,
故答案为:11.2g.
点评 本题考查混合物的计算,题目难度中等,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量,试题侧重考查学生的分析、理解能力.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
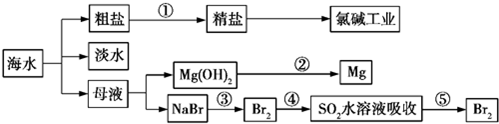
| A. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | ②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段 | |
| C. | ③④⑤中溴元素均被氧化 | |
| D. | 蒸馏法是技术最成熟也是最具发展前景的海水淡化方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
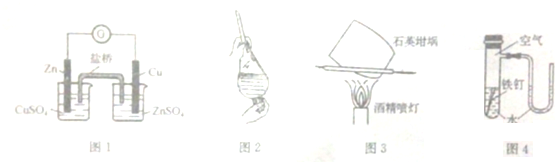
| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
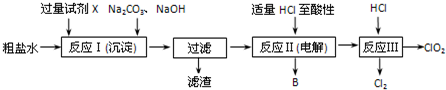
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
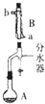 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com