
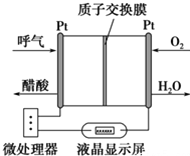
 ČēĶ¼ĖłŹ¾ŹĒŅ»ÖÖĖįŠŌČ¼ĮĻµē³Ų¾Ę¾«¼ģ²āŅĒ£¬¾ßÓŠ×Ō¶Æ“µĘųĮ÷ĮæÕģ²āÓėæŲÖĘµÄ¹¦ÄÜ£¬·Ē³£ŹŹŗĻ½ųŠŠĻÖ³”¾Ę¾«¼ģ²ā£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾ŹĒŅ»ÖÖĖįŠŌČ¼ĮĻµē³Ų¾Ę¾«¼ģ²āŅĒ£¬¾ßÓŠ×Ō¶Æ“µĘųĮ÷ĮæÕģ²āÓėæŲÖĘµÄ¹¦ÄÜ£¬·Ē³£ŹŹŗĻ½ųŠŠĻÖ³”¾Ę¾«¼ģ²ā£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | øƵē³ŲµÄøŗ¼«·“Ó¦Ź½ĪŖ£ŗCH3CH2OH+3H2O-12e-ØT2CO2”ü+12H+ | |
| B£® | øƵē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖ£ŗO2+4e-+4H+ØT2H2O | |
| C£® | µēĮ÷ÓÉO2ĖłŌŚµÄ²¬µē¼«¾ĶāµēĀ·Į÷ĻņĮķŅ»µē¼« | |
| D£® | Ī¢“¦ĄķĘ÷Ķعż¼ģ²āµēĮ÷“󊔶ų¼ĘĖć³ö±»²āĘųĢåÖŠ¾Ę¾«µÄŗ¬Įæ |
·ÖĪö øĆ×°ÖĆÖŠŗ¬ÓŠÖŹ×Ó½»»»Ä¤£¬Ōņµē½āÖŹČÜŅŗĪŖĖįŠŌ£¬ĖįŠŌĢõ¼žĻĀ£¬ŅŅ“¼Č¼ĮĻµē³ŲÖŠ£¬øŗ¼«ÉĻŅŅ“¼Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«ÉĻŹĒŃõĘųµĆµē×ӵĻ¹Ō·“Ó¦£»øł¾ŻĶ¼Ź¾µĆ³öĖįŠŌČ¼ĮĻµē³ŲµÄ·“Ó¦ĪļŗĶÉś³ÉĪļ£¬ŌŁøł¾ŻŌµē³ŲŌĄķŠ“³öøƵē³ŲµÄ·“Ó¦Ź½Ą“ÅŠ¶Ļ£®
½ā“š ½ā£ŗA”¢øƵē³ŲµÄøŗ¼«ÉĻŅŅ“¼Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬·ÖĪö×°ÖĆĶ¼æÉÖŖ¾Ę¾«ŌŚøŗ¼«±»ŃõĘųŃõ»Æ·¢ÉśŃõ»Æ·“Ӧɜ³É“×Ėį£¬CH3CH2OH-4e-+H2O=4H++CH3COOH£¬¹ŹA“ķĪó£»
B”¢ŅŅ“¼Č¼ĮĻµē³ŲÖŠ£¬Õż¼«ÉĻŹĒŃõĘųµĆµē×ӵĻ¹Ō·“Ó¦£¬O2ĖłŌŚµÄ²¬µē¼«“¦·¢Éś»¹Ō·“Ó¦O2+4e-+4H+ØT2H2O£¬¹ŹBÕżČ·£»
C”¢ŅŅ“¼Č¼ĮĻµē³ŲÖŠ£¬øŗ¼«ÉĻŅŅ“¼Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«ÉĻŹĒŃõĘųµĆµē×ӵĻ¹Ō·“Ó¦£¬µēĮ÷ÓÉÕż¼«Į÷Ļņøŗ¼«£¬¼““ÓO2ĖłŌŚµÄ²¬µē¼«¾ĶāµēĀ·Į÷ĻņĮķŅ»µē¼«£¬¹ŹCÕżČ·£»
D”¢øł¾ŻĪ¢“¦ĄķĘ÷Ķعż¼ģ²āµēĮ÷“óŠ”æÉŅŌµĆ³öµē×Ó×ŖŅʵÄĪļÖŹµÄĮ棬øł¾Żµē¼«·“Ó¦Ź½æÉŅŌ¼ĘĖć³ö±»²āĘųĢåÖŠ¾Ę¾«µÄŗ¬Į棬¹ŹDÕżČ·£®
¹ŹŃ”A£®
µćĘĄ ±¾ĢāŅŌŅŅ“¼ĪŖČ¼ĮĻæ¼²éĮĖČ¼ĮĻµē³Ų£¬ÄŃ¶Č²»“ó£¬×¢ŅāÕżøŗ¼«ÉĻµē¼«·“Ó¦Ź½µÄŹéŠ“ŅŖ½įŗĻµē½āÖŹČÜŅŗµÄĖį¼īŠŌ£¬¼“Ź¹Č¼ĮĻŗĶŃõ»Æ¼ĮĻąĶ¬£¬Čē¹ūµē½āÖŹČÜŅŗ²»Ķ¬£¬µē¼«·“Ó¦Ź½Ņ²²»Ķ¬£®


 Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø
Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
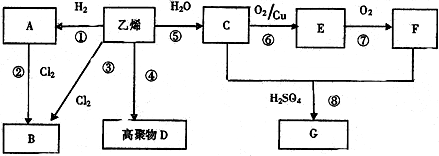
 £¬FÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒōČ»ł£»AµÄ¶žäå“śĪļµÄ½į¹¹ÓŠ2ÖÖ£®
£¬FÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒōČ»ł£»AµÄ¶žäå“śĪļµÄ½į¹¹ÓŠ2ÖÖ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1mol Fe3+ĶźČ«Ė®½ā£¬Éś³ÉĒāŃõ»ÆĢś½ŗĢåµÄŹżÄæĪŖNA | |
| B£® | 22.4 LCl2 ·Ö±šÓė×ćĮæµÄCu”¢FeĶźČ«·“Ó¦×ŖŅʵē×ÓŹż·Ö±šĪŖ2 NA”¢3NA | |
| C£® | ŹŅĪĀĻĀ£¬21.0gŅŅĻ©ŗĶ¶”Ļ©µÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄĢ¼Ō×ÓŹżÄæĪŖ1.5 NA | |
| D£® | 1 mol/L Mg£ØNO3£©2ČÜŅŗÖŠŗ¬ÓŠNO3-µÄŹżÄæĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¶ž¼×»łŃĒķæÓŠĻūŃ×Ö¹Ķ“”¢Õņ¾²µČ×÷ÓĆ£®¼×“¼ŗĶĮņ»ÆĒāŌŚ¦Ć-Al2O3“߻ƼĮ×÷ÓĆĻĀ
¶ž¼×»łŃĒķæÓŠĻūŃ×Ö¹Ķ“”¢Õņ¾²µČ×÷ÓĆ£®¼×“¼ŗĶĮņ»ÆĒāŌŚ¦Ć-Al2O3“߻ƼĮ×÷ÓĆĻĀ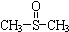 Éś³É¼×ĮņĆŃ£ØCH3-S-CH3£©£¬¼×ĮņĆŃŌŁÓėNO2·“Ó¦ÖĘČ”¶ž¼×»łŃĒķ棬ӊ¹Ų·“Ó¦ČēĻĀ£ŗ
Éś³É¼×ĮņĆŃ£ØCH3-S-CH3£©£¬¼×ĮņĆŃŌŁÓėNO2·“Ó¦ÖĘČ”¶ž¼×»łŃĒķ棬ӊ¹Ų·“Ó¦ČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
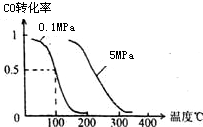 £Ø1£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬ČŻ»żĪŖ 10LĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗCH4£Øg£©+H2O£Øg£©?CO£Øg£©+3H2£Øg£©£»”÷H£¾0
£Ø1£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬ČŻ»żĪŖ 10LĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗCH4£Øg£©+H2O£Øg£©?CO£Øg£©+3H2£Øg£©£»”÷H£¾0²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪŽÉ«ĶøĆ÷ČÜŅŗÖŠ£ŗK+”¢Cu2+”¢SO42-”¢Na+ | |
| B£® | pH=12µÄČÜŅŗÖŠ£ŗK+”¢Na+”¢SO42-”¢CH3COO-”¢CO32- | |
| C£® | ¼ÓČėĀĮʬÄܷųöH2µÄČÜŅŗÖŠ£ŗNa+”¢HCO3-”¢Cu2+”¢SO42- | |
| D£® | ÓÉĖ®µēĄė³öµÄc£ØH+£©=1”Į10-12 mol/LµÄČÜŅŗÖŠ£ŗNH4+”¢Ba2+”¢NO3-”¢Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | X£¾Z£¾Y£¾M | B£® | X£¾M£¾Z£¾Y | C£® | M£¾Y£¾Z£¾X | D£® | M£¾X£¾Z£¾Y |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c=$\frac{¦Ń•w}{M}$ | B£® | c=$\frac{¦Ń•M}{w}$ | C£® | c=$\frac{M}{m•V}$ | D£® | c=$\frac{m}{M•V}$ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com