
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
分析 A.白色沉淀可能为AgCl;
B.观察Na的焰色反应不需要透过蓝色钴玻璃;
C.二者均与盐酸反应生成气体;
D.丁达尔效应现象为胶体特有的性质.
解答 解:A.白色沉淀可能为AgCl或硫酸钡,则该溶液中可能含有SO42-或银离子,但二者不能同时存在,故A错误;
B.观察Na的焰色反应不需要透过蓝色钴玻璃,可直接观察Na+离子火焰呈黄色,故B错误;
C.二者均与盐酸反应生成气体,则不能检验Na2CO3固体中是否混有NaHCO3,故C错误;
D.丁达尔效应现象为胶体特有的性质,则用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、物质鉴别和检验、胶体性质为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
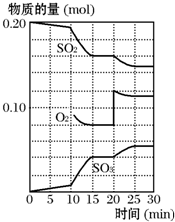 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱均会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用中和滴定法测定某盐酸的物质的量浓度.
用中和滴定法测定某盐酸的物质的量浓度.| 滴定次数 | 待测液体体积/mL | 标准碱液 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| ① | 20.0 | 0.40 | 20.41 |
| ② | 20.0 | 0.10 | 20.60 |
| ③ | 20.0 | 4.00 | 23.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
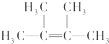 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.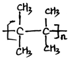 .
. 、(CH3CH2)2C=CH2(包括顺反异构).
、(CH3CH2)2C=CH2(包括顺反异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48g O2中含氧原子数为3NA | |
| B. | 标准状况下,22.4 L H2O中所含原子数为3NA | |
| C. | 1 mol/L的K2SO4溶液中,含2 NA个K+ | |
| D. | 24g Mg变为Mg2+时失去的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com