
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.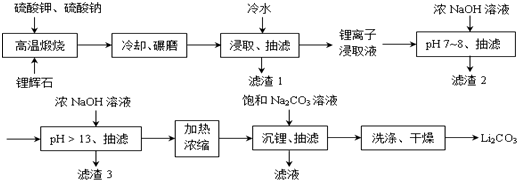
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
分析 I.锂的原子核外有2个电子层,各层电子数为2、1;Li与氮气反应生成Li3N;
Ⅱ.锂辉石(Li2O•Al2O3•4SiO2)煅烧后,冷却、研磨,有利于冷水的浸取,抽滤,得到滤渣为硅酸盐,结合锂离子浸取液中含有的金属离子、离子沉淀完全pH,可知加热NaOH浓溶液,调节溶液pH=7~8,Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,抽滤后再加入NaOH浓溶液,调节溶液pH>13,应是将Mn2+转化为沉淀,抽滤后,加热浓缩,加入饱和碳酸钠溶液,由于Li2CO3的溶解度远小于Li2SO4,会析出Li2CO3,由于Li2CO3的溶解度随温度升高而减小,用热水洗涤可减少Li2CO3的损失,得到最终产物碳酸锂.
(1)Li2SO4的溶解度随温度升高而减少;
(2)滤渣2为氢氧化铝、氢氧化铁;
(3)只加一次浓NaOH溶液使pH>13,会使溶液中Al3+转化为AlO2-,放置后,空气中二氧化碳与AlO2-、水反应生成Al(OH)3;
(4)Li2CO3的溶解度随温度升高而减小,加热浓缩,提高Li+ 浓度和溶液温度,利用析出Li2CO3;
(5)Li2CO3的溶解度随温度升高而减小,应用热水洗涤.
解答 解:I.锂的原子核外有2个电子层,各层电子数为2、1,原子结构示意图为: ,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
故答案为: ;6Li+N2=2Li3N;
;6Li+N2=2Li3N;
Ⅱ.锂辉石(Li2O•Al2O3•4SiO2)煅烧后,冷却、研磨,有利于冷水的浸取,抽滤,得到滤渣为硅酸盐,结合锂离子浸取液中含有的金属离子、离子沉淀完全pH,可知加热NaOH浓溶液,调节溶液pH=7~8,Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,抽滤后再加入NaOH浓溶液,调节溶液pH>13,应是将Mn2+转化为沉淀,抽滤后,加热浓缩,加入饱和碳酸钠溶液,由于Li2CO3的溶解度远小于Li2SO4,会析出Li2CO3,由于Li2CO3的溶解度随温度升高而减小,用热水洗涤可减少Li2CO3的损失,得到最终产物碳酸锂.
(1)Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率,故用冷水浸取,
故答案为:Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率;
(2)由上述分析可知,滤渣2为Al(OH)3、Fe(OH)3,
故答案为:Al(OH)3、Fe(OH)3;
(3)只加一次浓NaOH溶液使pH>13,会使溶液中Al3+转化为AlO2-,放置后,空气中二氧化碳与AlO2-、水反应生成Al(OH)3,Li2CO3产品中的杂质可能是Al(OH)3,相应的离子方程式为:Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:Al(OH)3;Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)Li2CO3的溶解度随温度升高而减小,加热浓缩,提高Li+ 浓度和溶液温度,使得Li2CO3容易析出,
故答案为:提高Li+浓度和溶液温度,使得Li2CO3容易析出;
(5)Li2CO3的溶解度随温度升高而减小,用热水洗涤可以减少碳酸锂的损耗,
故答案为:热水.
点评 本题考查物质制备实验方案、物质的分离提纯、对操作及条件控制的分析评价、对数据的分析运用等知识,是对学生综合能力的考查,题目难度中等,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.28mol | B. | 0.3lmol | C. | (n+0.2)mol | D. | (n+0.1)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
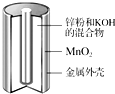 碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.
碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
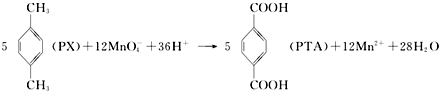
| A. | PTA是该反应的氧化产物 | |
| B. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| C. | PX分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗 1molPX,共转移12NA个电子 (NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
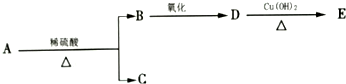 分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧与空气中的氮氧化合物发生作用后会产生光化学烟雾,对人体健康、植物成长等都有很大危害 | |
| B. | 农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物哪个)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com