
ijͬѧ��FeCl3���������Լ�FeSO4�����ȶ��Խ�������̽����
��1����������FeSO4���·ֽ⣬��Ӧ����ʽΪ�� 2FeSO4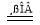 Fe2O3+SO2��+SO3����
Fe2O3+SO2��+SO3����
����˫���ű�����·ֽ�FeSO4�Ʊ�Fe2O3��Ӧ�е���ת�Ƶķ������Ŀ ��
��Ϊ�ռ�SO3����֤SO2��Ӧ����������ͨ����û�� �е�U����ϴ��ƿ�е� ��NaOH��Һ��
��2��ʵ��̽��Fe3+�������ԣ���FeCl3��Һ��ͨ��һ������SO2���壬��Һ�ɻ�ɫ��Ϊdz��ɫ��
��dz��ɫ��Һ��һ�����ڵ�������H+��Cl-�� �����ܴ��ڵ����� (��д���)��
A��Fe3+ B��Fe2+ C��SO42- D��H2SO3
��Ϊȷ�Ͽ��ܴ��ڵ�����Ӧѡ����Լ��� (��д���)��
A��ϡ���� B��NaOH��Һ C��KSCN��Һ D��Ʒ����Һ
�� ��2�֣�
��2�֣�
�� ��ˮ����Ʒ����Һ��������ȷ�𰸣���2�֣���
��2����BC��2�֣��� AD��2�֣���ѡ��һ����1�֣���ѡ0�֣�
�� CD��2�֣���ѡ��һ����1�֣���ѡ0�֣�
��������
�����������1��FeSO4���·ֽ�����ΪSO2��SO3���ռ�SO2���ȷ����SO3������SO3�ܷе�߳�����ΪҺ�壬���ñ�ˮ��ȴ���ɵõ�SO3����ʹ�����SO2���壻����SO2һ����Ʒ���Լ�����2����Һ�ɻ�ɫ��Ϊdz��ɫ��˵��Fe3+��SO2������Ӧ����Fe2+��SO4����������δ��Fe3+��Ӧ��SO2��ˮ��Ӧ����H2SO3��������������Ϊδ��Ӧ���Fe3+���������������ֱ���Ʒ����Һ��KSCN��Һ��
���㣺����������ԭ��Ӧ����ԭ���й����⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ̩���н�������һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������һ�ֻ��ý��������˾��н�����һ�������⣬�������Լ������ԡ������Ƶ������У���ȷ����
A����������ɫ�������۵�ͣ�Ӳ�ȴ�
B���Ʒ����ڿ����У���Ѹ�ٱ����������ɵ���ɫ��������
C������ʱ�������ƾ���ȼ�գ�������ɫ����
D���������Ż��������ĭ��������ø����ɳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�������
��ҵ��ͨ����ⱥ�͵�ʳ��ˮ����ȡ��������ȡ100mL��NaClΪ11.7g�ı���ʳ��ˮ���е�⣬
��1��д����ⱥ��ʳ��ˮ��ȡ�����Ļ�ѧ����ʽ
��2���ڱ�״�����Ƶ�Cl2��������
��3������NaOH�����ʵ���Ũ��Ϊ���٣������ǰ����Һ������ֲ��䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ֻ��һ���Լ����ܼ����NH4Cl��Na2SO4��(NH4)2CO3��������Һ��Ӧѡ��
A��BaCl2 B��HCl C��NaOH D��Ba(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������У����÷�Һ©�����з������
A��ˮ��CCl4 B����;ƾ� C���ƾ���ˮ D�����ͺ�ֲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�һ��ѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����װ���ܴﵽʵ��Ŀ����

A��ͼ1�����ų�������Ȼ�̼��Һ
B��ͼ2����ʵ�����ռ�SO2
C��ͼ3����ʵ�����Ʊ�Fe(OH)2
D��ͼ4�����Ƚ�NaHCO3��Na2CO3���ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�һ��ѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A��Cu��FeCl3��Һ��Ӧ��Cu+ Fe3+= Cu2++ Fe2+
B��̼�������ϡ���CO32- + 2H+ = H2O + CO2��
C��FeSO4��Һ��NaOH��Һ��Ӧ�� Fe2+ + 2OH- = Fe(OH)2��
D����������ˮ��Cl2 + H2O = 2H+ + ClO- + Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ��Ǩ�и�һ��ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij������FeCl3��Һ��ʴ����ͭ�ľ�Ե������ӡˢ��·������С��Ϊȷ��������ķ�Һ����ɣ���������ʵ�飺��1��ȡ10mL��Һ����������AgNO3��Һ�����ɳ��� 8.61g����2����ȡ10mL��Һ����ͭƬ��ַ�Ӧ��ͭƬ����������0.256g�����й���ԭ��Һ��ɵ��ж���������
A��һ������Fe 2+��Fe 3+��Cu2+��Cl��
B��c(Fe2+)�Uc(Cu2+) = 2�U1
C��c(Fe2+)�Uc(Fe 3+) = 3�U1
D��c(Cl��) = 6mol / L��c(Fe 2+) = 1.2mol / L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ��һ��ѧ��ѧ��������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������ӵĽṹʾ��ͼ�У�����ϡ������Ԫ�ص�ԭ����

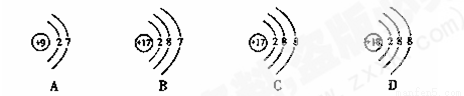
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com