
 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.

科目:高中化学 来源: 题型:
| A、S2-+2H2O?H2S+2OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、HCO3-+H2O?CO32-+H3O+ |
| D、HS-+H2O?H2S↑+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、S2-的结构示意图: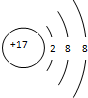 |
B、NaCl的电子式: |
| C、Cl2的结构式:Cl-Cl |
| D、NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
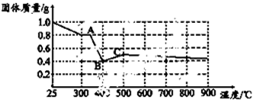 某课题组为探究淡黄色草酸亚铁晶体(FeC2O4?2H2O)的化学性质,进行了一系列实验探究.
某课题组为探究淡黄色草酸亚铁晶体(FeC2O4?2H2O)的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
取少量黑色固体, |
查看答案和解析>>
科目:高中化学 来源: 题型:
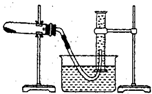
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,则E的分子式为
,则E的分子式为 结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
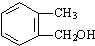 ,试写出D的属于芳香醇的其中2种同分异构体是
,试写出D的属于芳香醇的其中2种同分异构体是查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com