
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
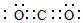 .
.分析 由元素在周期表的位置可知,①~⑩分别为H、He、Li、C、N、O、Na、Mg、Al、Cl,
(1)能显+1价,还能显-1价的元素位于IA族,金属无负价;金属性越强,对应高价氧化物对应的水化物的碱性越强;
(2)Li燃烧生成氧化锂,④与⑥形成的稳定化合物为二氧化碳;
(3)①、⑤、⑥三种元素形成的一种常见盐为硝酸铵;
(4)⑦与⑩形成的化合物为NaCl,焰色反应为元素的性质,电解熔融氯化镁可冶炼Mg.
解答 解:(1)能显+1价,还能显-1价的元素位于IA族,金属无负价,则元素为H;金属性越强,对应高价氧化物对应的水化物的碱性越强,则⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为NaOH、Mg(OH)2、Al(OH)3,
故答案为:H;NaOH、Mg(OH)2、Al(OH)3;
(2)Li燃烧生成氧化锂,方程式为4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O,④与⑥形成的稳定化合物为二氧化碳,其电子式为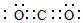 ,
,
故答案为:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O;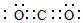 ;
;
(3)①、⑤、⑥三种元素形成的一种常见盐为硝酸铵,化学式为NH4NO3,含化学键为离子键、共价键,
故答案为:NH4NO3;离子键和共价键;
(4)⑦与⑩形成的化合物为NaCl,焰色反应为元素的性质,高温灼烧火焰为黄色;电解熔融氯化镁可冶炼Mg,工业上冶炼的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:黄;MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将SO2通入氢氧化钠的酚酞试液中 | 红色褪去 | SO2具有漂白性 |
| B | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液并水浴加热 | 无银镜产生 | 淀粉没有水解 |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,观察溶液颜色变化 | 红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向2mL 0.lmol/L的AgNO3溶液中先加入0.lmol/L的NaCl溶液3滴,再滴加0.lmol/L的NaI溶液3滴,观察沉淀颜色变化 | 先白色沉淀后出现黄色沉淀 | 溶度积:AgI比AgCl更小 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表的一部分.
如表为元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②⑤ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等的CO和N2质量一定相等 | |
| B. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 NA | |
| C. | 用过量NaOH溶液吸收 CO2的离子方程式:OH-+CO2=HCO3- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀时溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com