
【题目】当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:
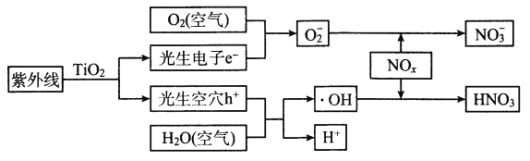
下列关于该“消除”过程的叙述不正确的是
A. 部分光能转变为化学能
B. 消除总变化为NOx+O2+H2O→HNO3
C. 消除反应能全天候发生
D. 使用纳米TiO2的消除效率更高
【答案】C
【解析】
由图中示意图可以看出,在TiO2催化作用下,紫外线提供能量,发生化学反应:NOx+O2+H2O→HNO3,纳米TiO2与紫外线接触面积更大,可以提高化学反应速率,据此分析解答。
A. 题中示意图表明,在TiO2的催化作用下紫外线提供能量,部分光能转变为化学能,故A项正确,不符合题意;
B. 题中示意图表明,在TiO2的催化作用下紫外线提供能量,发生反应:NOx+O2+H2O→HNO3,故B项正确,不符合题意;
C.没有紫外线时上述反应不能发生,故C项错误,符合题意;
D.纳米与紫外线接触面积更大,将产生更多的光生电子和光生空穴,从而消除更多的NOx,故D项正确,不符合题意;
答案选C;


科目:高中化学 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
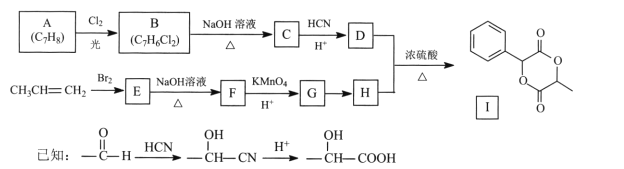
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1![]() 分别投入足量的0.1
分别投入足量的0.1![]() 的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计______(填“合理”或“不合理”),理由是________________________。
。此设计______(填“合理”或“不合理”),理由是________________________。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。

(3)仪器![]() 的名称为____________,干燥管
的名称为____________,干燥管![]() 的作用是__________________。
的作用是__________________。
(4)实验室中现有药品:![]() 溶液、
溶液、![]() 浓盐酸、
浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置![]() 、
、![]() 、
、![]() 中所装药品分别为____________、____________、____________,装置
中所装药品分别为____________、____________、____________,装置![]() 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
(5)若要证明非金属性:![]() ,则
,则![]() 中加__________,
中加__________,![]() 中加
中加![]() ,
,![]() 中加__________,观察到
中加__________,观察到![]() 中的现象为______________________________。
中的现象为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]

①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(p1、p2、p3、p4)的大小顺序为___,理由是___。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O)∶n(C2H4)=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
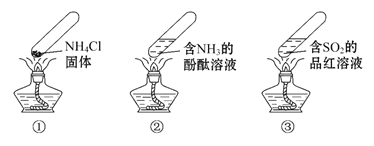
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____FeS2+_____H++_____N![]() =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________(填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Fe2(SO4)3和CuSO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42完全沉淀;如加入足量的NaOH溶液得沉淀c mol,则原溶液中的c(Fe3+)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:

(1)组装好上述实验装置后,在装入药品之前必需的实验操作是__。
(2)写出A中发生反应的化学方程式___。
(3)装置B的作用是除去产物中的SO2,发生的反应为 MnO4-+ SO2+ H2O= Mn2++ SO42-+ H+;配平该反应方程式___,若用酸性KMnO4溶液吸收标况下22.4LSO2,则反应转移的电子数为___。
(4)装置C的作用是__。
(5)用物质的量浓度为18.4mol/L的浓硫酸配制500mL0.5mol/L的稀硫酸,主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__,定容时由于仰视刻度线,则对所配溶液浓度产生的影响为__(填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com