
下列离子方程式正确的是
A.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓+2HClO
B.NH4HSO3溶液与足量NaOH溶液共热:NH +H++2OH-==NH3↑+2H2O
+H++2OH-==NH3↑+2H2O
C. 向1L 1mol/L碘化亚铁溶液中通入标准状况下22.4L氯气:2Fe2+-+Cl2=2Fe3+2Cl-
D.澄清石灰水与少量的小苏打溶液混合:Ca2+ + OH-+ HCO3- CaCO3↓+ H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、乙醇与金属钠反应产生氢气 | B、乙醇在浓硫酸存在下加热产生乙烯 | C、乙醇与氢卤酸发生取代反应生成卤代烃 | D、乙醇与酸性重铬酸钾溶液作用 |
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
用 NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA
B.4.2 g丙烯中所含的共价键数目为0.6NA
C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 NA
D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
某溶液中可能含有下列离子:Na+、Mg2+、NH4+、Cl―、SO32―、SO42―、NO3―和NO2―等,现将该溶液分成4份,分别进行如下实验:①酸化后滴加适量的淀粉KI溶液,呈蓝色;②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。则下列说法不正确的是
A.该溶液中一定含有NO3―、SO42―、NH4+
B.根据实验④可推出溶液中不存在NO2―与SO32―
C.往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl―
D.根据实验①可推出溶液中含有NO3―或NO2―
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:填空题
(9分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
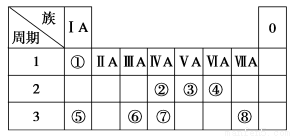
(1)画出⑧原子结构示意图__________ __
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________。
(用离子符号表示)
(3)①-⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是__________________________ _(用离子方程式表示),该氢化物分子空间结构为______ _
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式_________________________ _
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:选择题
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论。以下几个
类比推理结论中正确的是
A.CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成
B.在常温下,Na2CO3+2HCl=2NaCl+CO2↑+H2O,说明HCl酸性强于H2CO3;
在高温下,Na2CO3+SiO2= Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3;
C.H2SO4为强酸,推出HClO4为强酸
D.NH3的沸点高于PH3,推出CH4沸点高于SiH4
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:推断题
(7分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1) F的组成元素在元素周期表中的位置______________。
(2) B和C反应的化学方程式为_____________________________。
(3) E与G的稀溶液反应的离子方程式为______________________。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一
B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一
C.pH=12的溶液: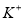 、
、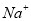 、
、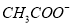 、Br-
、Br-
D.由水电离产生的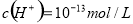 的溶液:
的溶液: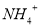 、
、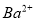 、
、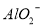 、
、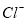
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液。由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④
C.①② D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com