
| A. | 当容器内反应物和产物共存且浓度比等于化学计量数比时,反应达到平衡状态 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后若扩大容器体积,平衡正向移动,氮气浓度变大 |
分析 A.达到平衡状态时,浓度之比不一定等于化学计量数之比,且可逆反应中反应物、生成物一定同时存在;
B.加入氨气后,氨气浓度增大,平衡向着正向移动,但是氨气的转化率会减小;
C.升高温度,正逆反应速率都增大;
D.扩大容器体积,减小了压强,平衡向着正向移动,但是氮气的浓度会减小.
解答 解:A.可逆反应中,反应物和生成物一定同时存在,浓度比等于化学计量数比时,不一定达到平衡状态,关键看正逆反应速率是否相等,故A错误;
B.达平衡后再通入NH3,氨气的浓度增大,平衡正向移动,由于消耗的氨气不如增加的氨气多,导致NH3转化率会减小,故B正确;
C.该反应为放热反应,升高温度后平衡向着逆向移动,但是升高温度后正逆反应速率都增大,故C错误;
D.平衡后若扩大容器体积,容器内压强减小,化学平衡正向移动,由于增加的氮气不如容器体积影响大,导致氮气浓度减小,故D错误;
故选B.
点评 本题考查了化学平衡及其影响,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | a是锌,b是铜,c是硫酸溶液 | B. | a是铁,b是银,c是硝酸银溶液 | ||
| C. | a是银,b是铁,c是硝酸银溶液 | D. | a是铁,b是碳,c是氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③>①>② | D. | ①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
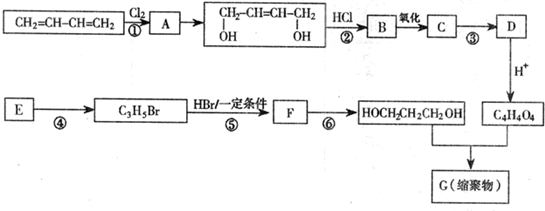
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com