
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_______。
(3)B中溶液发生反应的离子方程式是_______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________。
(5)过程Ⅲ实验的目的是__________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能离逐渐减弱。
【答案】![]() 淀粉KI试纸变蓝 Cl2+2Br-═Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 确认C的黄色溶液中五Cl2,排除Cl2对溴置换碘实验的干扰 原子半径逐渐增大
淀粉KI试纸变蓝 Cl2+2Br-═Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 确认C的黄色溶液中五Cl2,排除Cl2对溴置换碘实验的干扰 原子半径逐渐增大
【解析】
验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,以此解答该题。
(1)根据以上分析,黄绿色气体为氯气,由高锰酸钾和浓盐酸发生氧化还原反应生成,氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构,电子式为:![]() ,
,
故答案为:![]() ;
;
(2)淀粉变蓝色,说明有单质碘生成,说明氯气氧化性强于单质碘,
故答案为:淀粉KI试纸变蓝;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-,
故答案为:Cl2+2Br-═Br2+2Cl-;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,
故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡.静至后CCl4层溶液变为紫红色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,
故答案为:原子半径逐渐增大。


科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
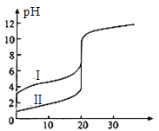
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下列实验装置制备并研究SO2的性质,请按要求回答下列问题(夹持装置和A中加热装置已省略)。
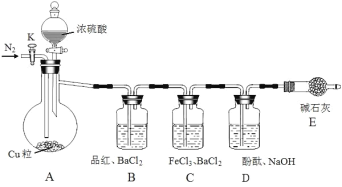
操作步骤择要如下:
Ⅰ.打开活塞K,先通入一段时间N2,再关闭活塞K,加热A一段时间;
Ⅱ.A中不再产生气体后,停止加热,打开活塞K,缓慢通入氮气直至A装置冷却。
(1)装有Cu粒的仪器名称是________。
(2)实验室可用亚硫酸钠与浓硫酸制取SO2,该化学方程式是_______。
(3)下列说法正确的是____
A. 装置应在加入药品后检验装置气密性
B. 操作Ⅱ中继续通入氮气可以避免溶液出现倒吸
C. 装置A中的浓硫酸体现出了强氧化性、酸性
D. 装置B和装置D中都出现了褪色,是因为SO2有漂白性
(4)装置C中出现白色浑浊,请用离子方程式解释原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 双酚A也被称为BPA,可用于生产塑料。回答下列问题:
双酚A也被称为BPA,可用于生产塑料。回答下列问题:
(1)下列关于双酚A的叙述不正确的是____(填序号)。
①在水中的溶解度可能小于苯酚②可以发生还原反应③不能使酸性KMnO4溶液褪色④可与NaOH溶液反应⑤双酚A的核磁共振氢谱显示氢原子数之比为1﹕2﹕2﹕3⑥1mol双酚A最多消耗2molBr2
(2)双酚A的一种合成路线如图所示:

①丙烯→A的反应类型是____。
②A→B反应方程式是____。
③D的名称是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:
①乙烯和2-丁烯;
②CH4和![]() ;
;
③CH3CH2OH和CH3—O—CH3;
④ 和
和 ;
;
⑤CH2=CH—CH=CH2和CH3C≡CCH3;
⑥ 和
和 ;
;
⑦![]() C和
C和![]() C;
C;
⑧O2与O3;
⑨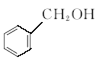 与
与
试回答下列问题:
(1)每组中的物质互为同分异构体的是_________(填编号,下同)。
(2)每组中的物质互为同系物的是_____。
(3)每组中的物质属于同一物质的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十亿年来,地球上的物质不断的变化,大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分,用下表涉及的分子回答下列问题。
原始大气的主要成分 | CH4、NH3、CO、CO2等 |
目前空气的主要成分 | N2、O2、CO2、水蒸气、稀有气体(He、Ne等) |
(1)含有非极性共价键的分子是______(填化学式)
(2)含有极性共价键的非极性分子是______(填化学式)
(3)H2O中心原子的杂化方式及分子构型为______
(4)图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物。其中代表CH4的是______(填字母序号)
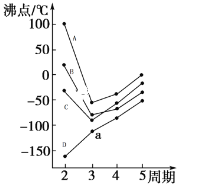
(5)根据NH3H2ONH4++OH-,用氢键表示式写出氨分子和水分子之间最主要存在的氢键形式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断不正确的是( )

A.四种元素的单质中,X的熔沸点最低
B.最高价氧化物对应水化物的酸性W比Z强
C.X的气态氢化物的稳定性较Z的弱
D.原子半径:Y>Z>W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0。下列判断正确的是
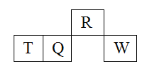
A.原子半径的大小:W>Q>R
B.气态氢化物的稳定性:R>Q>T
C.对应含氧酸的酸性强弱:W>Q>T
D.R分别与T、Q、W形成化合物的晶体均为分子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com