
下列化合物,按其晶体的熔点由高到低排列正确的是
A.SiO2 CsCl CBr4 CF4 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
[化学—物质结构与性质]石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。

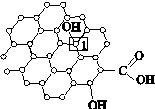
(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
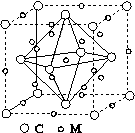
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为 个。
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为 。
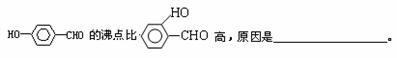
(3) H+可与H2O形成H3O+,H3O+中O原子采用 杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为 。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3, 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国稀土资源丰富。下列有关稀土元素 与
与 的说法正确的是( )
的说法正确的是( )
A.  与
与 互为同位素
互为同位素
B.  与
与 的质量数相同
的质量数相同
C.  与
与 是同一种核素
是同一种核素
D.  与
与 的核外电子数和中子数均为62
的核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学键与晶体结构说法正确的是
A 两种元素组成的分子中一定只有极性键
B 离子化合物的熔点一定比共价化合物的高
C 非金属元素组成的化合物一定是共价化合物
D 含有阴离子的化合物一定含有阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com