
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
分析 A.弱酸是酸在水溶液中部分电离的化合物;
B.和酸反应生成盐和水的氧化物为碱性氧化物,发生的是氧化还原反应;
C.金属阳离子和酸根阴离子构成的化合物为盐;
D.不同物质组成的为混合物.
解答 解:A.H2CO3、H2SiO3、HClO水溶液中都存在电离平衡,都属于弱酸,故A正确;
B.Na2O、MgO和酸反应生成盐和水都属于碱性氧化物,Al2O3 和酸、碱都反应生成盐和水,属于两性氧化物,故B错误;
C.石英主要成分是二氧化硅属于氧化物,纯碱是碳酸钠、明矾是硫酸铝钾都属于盐,故C错误;
D.碱石灰是氧化钙和氢氧化钠的混合物,铁红是氧化铁的俗称为纯净物,水泥是硅酸盐的混合物都属于混合物,故D错误;
故选A.
点评 本题考查了物质分类、物质组成、物质名称等知识点的分析判断,注意知识积累,题目较简单.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
 ②
②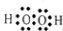 ③
③ ④
④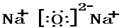 ⑤
⑤ ⑥
⑥ ⑦
⑦
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
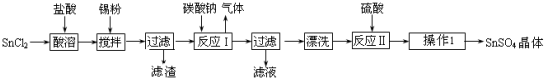
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积比1:1 | B. | 体积比11:16 | C. | 分子个数比1:1 | D. | 密度比11:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
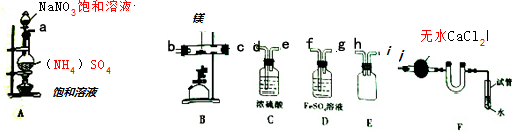
| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com