
【题目】(1)卤族元素组成的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识它们。
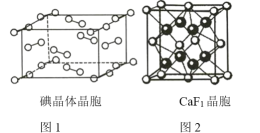
①如图1为碘晶体的晶胞结构。有关说法正确的是_________(填序号)。
a.平均每个晶胞中有4个碘分子
b.平均每个晶胞中有4个碘原子
c.碘晶体为无限延伸的空间结构,是原子晶体
d.碘晶体中存在的相互作用有非极性键和范德华力
②已知CaF2晶胞(图2)的密度为ρ g/cm3,NA表示阿伏加德罗常数的值,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量可表示为_________________。
(2)以MgCl2为原料用电解熔融盐法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有_______________。
(3)有研究表明,化合物X可用于研究模拟酶,当结合 或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:

①A中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有_________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较A和B中微粒间相互作用力的差异:________________。
【答案】ad ![]() g/mol 增强熔融盐的导电性 σ A 中存在分子间氢键,B中存在配位键
g/mol 增强熔融盐的导电性 σ A 中存在分子间氢键,B中存在配位键
【解析】
(1)①a.碘晶体的构成微粒是I2,I2位于晶胞的顶点和面心上,所以一个晶胞中含有的I2分子数目为8×![]() +6×
+6×![]() =4,a正确;
=4,a正确;
b. 根据选项a分析可知一个晶胞中含有4个I2分子,则含有的I原子数目为4×2=8个,b错误;
c. 碘晶体为无限延伸的空间结构,构成微粒为分子,属于分子晶体,c错误;
d. 碘晶体中的I2分子内碘原子间存在I-I为非极性键,且晶体中分子之间存在范德华力,故碘晶体中存在的相互作用有非极性键和范德华力,d正确;
故合理选项是ad;
②该晶胞中含有Ca2+的个数为![]() ,氟离子的个数为8×1=8,一个晶胞中含有4个CaF2,晶胞体积V=a3 cm3,CaF2密度ρ g/cm3,ρ=
,氟离子的个数为8×1=8,一个晶胞中含有4个CaF2,晶胞体积V=a3 cm3,CaF2密度ρ g/cm3,ρ=![]() ,则CaF2的摩尔质量=
,则CaF2的摩尔质量=![]() g/mol,故M相对分子质量
g/mol,故M相对分子质量![]() ;
;
(2)离子浓度越大,其熔融盐的导电性越强,所以MgCl2为原料用电解熔融盐法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有增大离子浓度,从而增大熔融盐的导电性;
(3)①根据σ键是共价单键,可以旋转,而π键不能旋转,根据A中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有σ键的特点;
②根据图片知,A中含有氢键,B中含有配位键,则A和B中微粒间相互作用力的差异是A中含有氢键,B中含有配位键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某多肽的化学式为![]() ,完全水解后只得到以下三种氨基酸:
,完全水解后只得到以下三种氨基酸:![]() (甘氨酸)、
(甘氨酸)、![]() (赖氨酸)和
(赖氨酸)和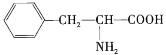 (苯丙氨酸)
(苯丙氨酸)
(1)该多肽为_______肽。
(2)![]() 该多肽完全水解后能生成__________
该多肽完全水解后能生成__________![]() 甘氨酸、_______
甘氨酸、_______![]() 苯丙氨酸、_______
苯丙氨酸、_______![]() 赖氨酸。
赖氨酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________________。下图是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____________反应(填“放热”或“吸热”)。

(2)500℃该反应的平衡常数为______(保留两位小数),若提高温度到800℃进行,达平衡时,K值______(填“增大”、“减小”或“不变”)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______v(逆)(填“>”、“<”或“=”)。
(4)下列措施能使 增大的是______。
增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯的结构简式为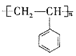 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的分子式为__________,链节是____________,单体是_________________。
(2)实验测得聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度![]() 为________。
为________。
(3)一定条件下合成聚苯乙烯的化学方程式为______,该反应类型为_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
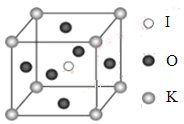
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y![]() 乙酸乙酯,下列说法错误的是
乙酸乙酯,下列说法错误的是
A.X可用新制的氢氧化铜悬浊液检验
B.实验室由Y和M制取乙酸乙酯时可用饱和NaOH溶液来提纯
C.由Y生成乙酸乙酯的反应属于取代反应
D.可用碘水检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
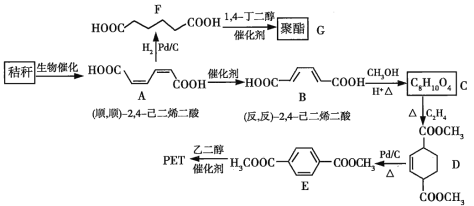
回答下列问题:
(1)下列关于糖类的说法正确的是_________。(填标号)
a 糖类都有甜味,具有![]() 的通式 b 麦芽糖水解生成互为同分异构体的葡萄糖和果糖
的通式 b 麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c 用银镜反应不能判断淀粉水解是否完全 d 淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为___________。
(3)D中的官能团名称为_________,D生成E的反应类型为_________。
(4)F的化学名称是________。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,![]() 与足量碳酸氢钠溶液反应生成
与足量碳酸氢钠溶液反应生成![]() ,W共有_____种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为______。
,W共有_____种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为______。
(6)参照上述合成路线,以(反,反)![]() ,
,![]() 已二烯和
已二烯和![]() 为原料(无机试剂任选),设计制备对苯二甲酸的合成路线______。
为原料(无机试剂任选),设计制备对苯二甲酸的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为_______,Co的第四电离能比 Fe 的第四电离能要小得多,原因是__________________________。
(2)Co2+ 、Co3+都能与 CN一形成配位数为6的配离子。CN一中碳原子的杂化方式为____________;HCN分子中含有![]() 键的数目为__________________。
键的数目为__________________。
(3)用KCN处理含Co2+的盐溶液 ,有红色的Co(CN)2 析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6] 4- ,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN )6]3-,写出该反应的离子方程式:_______________。
(4)金属钴的堆积方式为六方最密堆积,其配位数是 _____。有学者从钴晶体中取出非常规的“六棱柱”晶胞,结构如图所示,该晶胞中原子个数为_____,该晶胞的边长为a nm,高为c nm,该晶体的密度为___gcm-3(NA表示阿伏加德罗常数的值,列出代数式)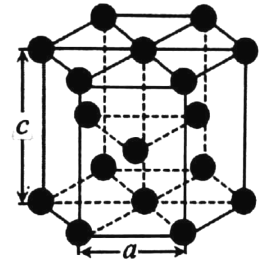
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
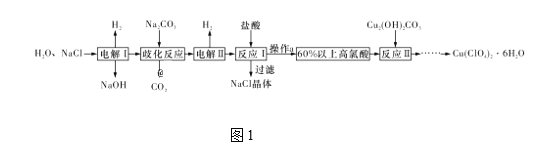
(1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________。
(3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。
(4)操作a的名称是____。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com