
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的负极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被氧化 |
分析 A、不锈钢和铝合金等耐腐蚀;
B、金属作原电池的正极被保护;
C、酸性较强时Fe主要发生析氢腐蚀,中性或弱酸性发生吸氧腐蚀;
D、金属被腐蚀实质是金属失电子.
解答 解:A、不锈钢和铝合金等耐腐蚀,所以合金也可能耐腐蚀,故A错误;
B、金属作原电池的正极被保护,所以可以用原电池原理来减缓金属的腐蚀,故B错误;
C、酸性较强时Fe主要发生析氢腐蚀,中性或弱酸性发生吸氧腐蚀,所以钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同,负极反应相同,均是铁失去电子,故C错误;
D、金属被腐蚀实质是金属失电子,所以无论哪种类型的腐蚀,其实质都是金属被氧化,故D正确.故选D.
点评 本题考查学生金属的腐蚀和防护知识,注意把握金属的腐蚀原理和防护方法,注意基本概念的理解和掌握是关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布的周期性变化 | |
| B. | 元素的相对原子质量逐渐增大 | |
| C. | 元素化合价的周期性变化 | |
| D. | 元素原子的核外电子层数的逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和N2 | B. | CO2和NO2 | C. | CO2和O2 | D. | CO2、N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
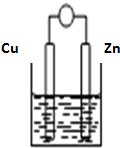 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:
当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
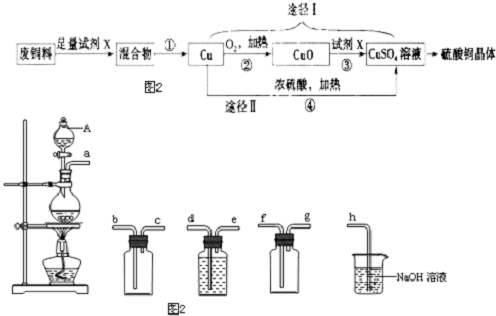
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com