
铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。
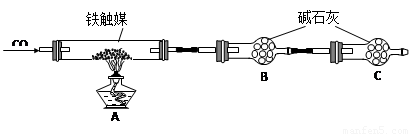
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
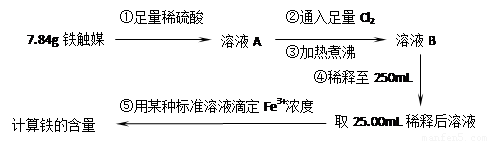
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
|
实验操作 |
实验现象与结论 |
|
|
|
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。
(15分)
(1)250mL容量瓶 (2分)
(2)FeCl2 或者FeSO4或者Fe2+ (2分)
(3)方案一:
|
实验操作 |
预期现象和结论 |
|
取适量溶液B于试管中,滴加 2-3滴紫色石蕊试液,振荡,观察现象,放置一段时间后,在观察现象。(2分) |
若溶液显红色后,红色有褪去,则溶液B中含Cl2(2分);若溶液不褪色,则溶液B不含有Cl2(2分) |
方案二:
|
实验操作 |
预期现象和结论 |
|
取适量溶液B于试管中,滴加 2-3滴品红稀溶液,振荡,观察现象(2分) |
若溶液褪色,则溶液B中含Cl2(2分);若溶液不褪色,则溶液B不含有Cl2(2分) |
(4)防止空气中的CO2和水蒸气进入B中 (2分)
(5)Fe4O5 或2FeO·Fe2O3 (3分)
【解析】
试题分析:(1)步骤④为配制一定浓度的溶液,按实验时使用的先后顺序,需要的仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管;(2)由于铁触媒的主要成分是铁的氧化物,铁的氧化物都是碱性氧化物,可溶于足量稀硫酸,则溶液A的主要成分是硫酸铁、硫酸亚铁和硫酸,氯气具有强氧化性,亚铁离子具有还原性,则通入氯气的目的是将亚铁离子氧化为铁离子,若氯气不足,则溶液B中除硫酸铁外还有硫酸亚铁或氯化亚铁,亚铁离子的存在会影响滴定时消耗标准溶液的体积,影响测定结果;(3)若通入氯气过量,则溶液中只含有铁离子,不含亚铁离子,铁离子对检验溶液中可能含有的氯气有干扰,因为它们都具有氧化性,都能使淀粉-KI溶液变蓝,因此不能选择淀粉-KI溶液检验氯气的存在与否,也不能选择酸性高锰酸钾溶液或KSCN溶液,因为它们与氯气相遇时无明显变化,只能根据氯气与水反应生成盐酸的酸性和次氯酸的强氧化性设计实验方案;方案一:取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象,放置一段时间后,再观察现象,若溶液显红色后,红色有褪去,则溶液B中含Cl2;若溶液不褪色,则溶液B不含有Cl2;方案二:取适量溶液B于试管中,滴加2-3滴品红稀溶液,振荡,观察现象,若溶液褪色,则溶液B中含Cl2;若溶液不褪色,则溶液B不含有Cl2;(4)干燥管B中碱石灰的目的是吸收CO与铁触媒反应生成的二氧化碳,干燥管C中碱石灰的目的是防止空气中的CO2和水蒸气进入B中,干扰铁触媒组成的测定实验;(5)由于碱石灰与过量的CO不反应,只能吸收CO2,则干燥管B增加的质量就是A中反应生成的CO2的质量,由于CO2的相对分子质量为44,m/M=n,则n(CO2)=11.0g÷44g/mol=0.25mol;根据碳元素守恒可得关系式:CO~CO2,则参加反应的n(CO)= n(CO2)=0.25mol,由于n•M=m,则m(CO)=0.25mol×28g/mol=7.0g;由于m(CO2)—m(CO)= 11.0g—7.0g=4.0g,根据氧元素质量守恒可得,铁触媒中氧元素的质量为4.0g;由于铁触媒的质量为15.2g,则其中铁元素的质量为15.2g—4.0g=11.2g;由于m/M=n,则n(Fe)=11.2g÷56g/mol=0.20mol,则n(O)=4.0g÷16g/mol=0.25mol;铁触媒中铁、氧原子的物质的量之比为0.20∶0.25=4∶5,则铁触媒的化学式为Fe4O5 或2FeO·Fe2O3。
考点:考查化学实验方案的设计与评价,涉及配制一定体积溶液所用仪器、溶液B的主要成分、设计检验溶液B中是否含有氯气的方案、干燥管C中碱石灰的作用、铁触媒化学师的测定和计算等。


科目:高中化学 来源: 题型:阅读理解
| 84(m1-m2) |
| 31m1 |
| 84(m1-m2) |
| 31m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试化学试卷(解析版) 题型:实验题
(16分)铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。
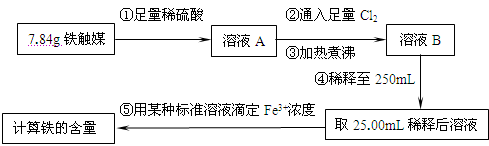
(1)步骤④后面需用 (填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
|
实验操作 |
实验现象与结论 |
|
|
|
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
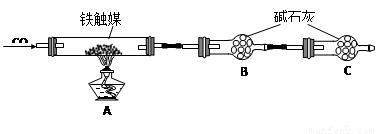
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。(相对原子质量:C-12 O-16 Fe-56)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省青岛市高三上学期期中考试化学试卷(解析版) 题型:填空题
铁及其化合物在生活、生产中有着广泛的应用。
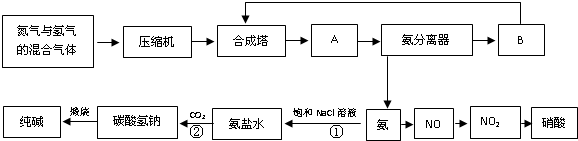
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
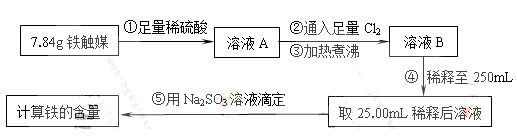
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为 。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
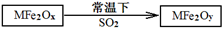
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com